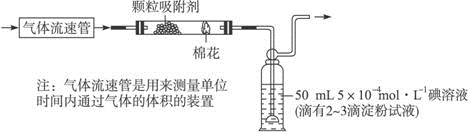
题目内容
 实验室制取乙烯常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.
实验室制取乙烯常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.①如图上所示,I、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是:(将下列有关试剂的序号填入空格内).
I
A.品红溶液 B.NaOH溶液
C.浓H2SO4 D.溴水
②能说明二氧化硫气体存在的现象是
③装置Ⅱ中发生反应的离子方程式
④使用装置Ⅲ的目的是
⑤装置Ⅳ中发生反应的方程式是
考点:性质实验方案的设计
专题:实验设计题
分析:二氧化硫是否存在可用品红溶液检验;检验乙烯可以用溴水或高锰酸钾酸性溶液;乙烯和二氧化硫都能使溴水或高锰酸钾酸性溶液褪色;
乙烯与溴水发生加成反应使溴水褪色:CH2=CH2+Br2→CH2Br-CH2Br,乙烯被酸性高锰酸钾氧化使其褪色.二氧化硫与溴水、酸性高锰酸钾发生氧化还原反应,5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4,SO2+Br2+H2O═H2SO4+2HBr;
乙烯不与NaOH溶液反应,但二氧化硫能与碱反应(SO2+2NaOH=Na2SO3+H2O),故乙烯的检验应放在排除SO2的干扰后进行,选通过品红溶液褪色检验SO2的存在;再通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色实验检验乙烯.
乙烯与溴水发生加成反应使溴水褪色:CH2=CH2+Br2→CH2Br-CH2Br,乙烯被酸性高锰酸钾氧化使其褪色.二氧化硫与溴水、酸性高锰酸钾发生氧化还原反应,5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4,SO2+Br2+H2O═H2SO4+2HBr;
乙烯不与NaOH溶液反应,但二氧化硫能与碱反应(SO2+2NaOH=Na2SO3+H2O),故乙烯的检验应放在排除SO2的干扰后进行,选通过品红溶液褪色检验SO2的存在;再通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色实验检验乙烯.
解答:
解:①乙烯不与NaOH溶液反应,但二氧化硫能与碱反应(SO2+2NaOH=Na2SO3+H2O),二氧化硫是否存在可用品红溶液检验,乙烯的检验应放在排除SO2的干扰后进行,选通过品红溶液褪色检验SO2的存在;再通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净.最后用高锰酸钾酸性溶液褪色实验检验乙烯,
故答案为:A;B;A;D;
②二氧化硫是否存在可用品红溶液检验,品红溶液褪色说明含有二氧化硫,故答案为:装置Ⅰ中品红溶液褪色;
③根据以上分析,装置Ⅱ中是用氢氧化钠吸收二氧化硫,离子方程式为:SO2+2OH-=SO32-+H2O,故答案为:SO2+2OH-=SO32-+H2O;
④通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,故答案为:检查二氧化硫是否除尽;
⑤根据以上分析,装置Ⅳ中是用溴水来检验乙烯,反应的方程式是CH2=CH2+Br2→CH2Br-CH2Br,故答案为:CH2=CH2+Br2→CH2Br-CH2Br.
故答案为:A;B;A;D;
②二氧化硫是否存在可用品红溶液检验,品红溶液褪色说明含有二氧化硫,故答案为:装置Ⅰ中品红溶液褪色;
③根据以上分析,装置Ⅱ中是用氢氧化钠吸收二氧化硫,离子方程式为:SO2+2OH-=SO32-+H2O,故答案为:SO2+2OH-=SO32-+H2O;
④通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,故答案为:检查二氧化硫是否除尽;
⑤根据以上分析,装置Ⅳ中是用溴水来检验乙烯,反应的方程式是CH2=CH2+Br2→CH2Br-CH2Br,故答案为:CH2=CH2+Br2→CH2Br-CH2Br.
点评:本题考查乙烯的化学性质、制备以及常见气体的检验,题目难度不大,注意实验的先后顺序.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、7.8 gNa2O2与足量的水反应,转移的电子数为0.1NA |
| B、用含有0.1molFeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒数等于0.1NA |
| C、25℃时,pH=13的1LBa(OH)2溶液中含有的OH-数为0.2NA |
| D、100mL 12 mol?L-1浓盐酸与足量MnO2加热反应,产生的氯气分子数为0.3NA |
已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )


| A、Z元素的原子半径可能比Y元素的小 |
| B、W的原子序数可能是Y的原子序数的2倍 |
| C、W的气态氢化物的稳定性一定比Y的强 |
| D、Z的化学活泼性一定比X强 |