题目内容
已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )


| A、Z元素的原子半径可能比Y元素的小 |
| B、W的原子序数可能是Y的原子序数的2倍 |
| C、W的气态氢化物的稳定性一定比Y的强 |
| D、Z的化学活泼性一定比X强 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:这几种元素属于短周期元素,根据元素在周期表中的位置知,X和Y位于第二周期、Z和W属于第三周期,
A.同一主族元素中,原子半径随着原子序数的增大而增大;
B.设Y的原子序数为y,则Z的原子序数为y+8,W的原子序数为y+9;
C.若W为Cl,则Y为O,根据二者的非金属性判断氢化物的稳定性;
D.若Z为Cl,则X为O,根据二者的非金属性分析.
A.同一主族元素中,原子半径随着原子序数的增大而增大;
B.设Y的原子序数为y,则Z的原子序数为y+8,W的原子序数为y+9;
C.若W为Cl,则Y为O,根据二者的非金属性判断氢化物的稳定性;
D.若Z为Cl,则X为O,根据二者的非金属性分析.
解答:
解:这几种元素属于短周期元素,根据元素在周期表中的位置知,X和Y位于第二周期、Z和W属于第三周期,
A.同一主族元素中,原子半径随着原子序数的增大而增大,Y和Z属于同一主族,且Z的原子序数大于Y,所以Z元素的原子半径比Y元素的大,故A错误;
B.设Y的原子序数为y,则Z的原子序数为y+8,W的原子序数为y+9,y+9=2y,则y=9,所以W的原子序数可能是Y的原子序数的2倍,故B正确;
C.若W为Cl,则Y为O,非金属性越强,对应的氢化物越稳定,非金属性O大于Cl,则H2O的稳定性大于HCl,则W的气态氢化物的稳定性不一定比Y的强,故C错误;
D.若Z为Cl,则X为O,非金属性O大于Cl,则O的化学活泼性比Cl强,所以Z的化学活泼性不一定比X强,故D错误;
故选B.
A.同一主族元素中,原子半径随着原子序数的增大而增大,Y和Z属于同一主族,且Z的原子序数大于Y,所以Z元素的原子半径比Y元素的大,故A错误;
B.设Y的原子序数为y,则Z的原子序数为y+8,W的原子序数为y+9,y+9=2y,则y=9,所以W的原子序数可能是Y的原子序数的2倍,故B正确;
C.若W为Cl,则Y为O,非金属性越强,对应的氢化物越稳定,非金属性O大于Cl,则H2O的稳定性大于HCl,则W的气态氢化物的稳定性不一定比Y的强,故C错误;
D.若Z为Cl,则X为O,非金属性O大于Cl,则O的化学活泼性比Cl强,所以Z的化学活泼性不一定比X强,故D错误;
故选B.
点评:本题考查了元素周期表和元素周期律知识,根据元素在周期表中的位置及元素的性质、元素周期律知识来分析解答,知道元素周期表结构并灵活运用元素周期律是解本题关键,同时考查学生发散思维能力,题目难度中等.

练习册系列答案
相关题目
一个12C的质量为akg,一个12CO2分子的质量为bkg,若以12CO2分子中的一个氧原子的质量为
作为相对原子质量的标准,则12CO2的相对分子质量为( )
| 1 |
| 16 |
A、
| ||
B、
| ||
C、
| ||
D、
|
在120℃、101kPa时,将1LC3H8和若干升O2混合,点燃使之充分反应.反应后,恢复到原温度和原压强,测的气体体积为m L.若通过碱石灰,气体体积变为n L.若 m-n=6,则n L气体为( )
| A、O2 |
| B、CO |
| C、CO2 |
| D、CO和O2 |
一定条件下,跟1mol 反应的H2或溴水中Br2的最大量分别是( )
反应的H2或溴水中Br2的最大量分别是( )
 反应的H2或溴水中Br2的最大量分别是( )
反应的H2或溴水中Br2的最大量分别是( )| A、11mol,9mol |
| B、9 mol,6mol |
| C、6mol,5 mol |
| D、l3 mol,9mol |
实验是研究化学的基础,图中所示的实验方法、装置或操作完全不正确的是( )
A、 除杂 |
B、 稀释 |
C、 制气 制气 |
D、 称量 称量 |
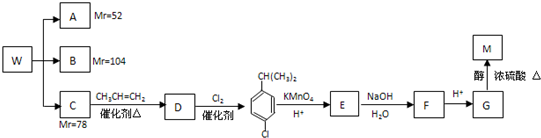
 实验室制取乙烯常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.
实验室制取乙烯常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.
 ).
).
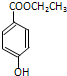
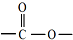 ,且无环状结构的同分异构体有
,且无环状结构的同分异构体有