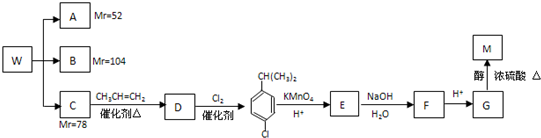
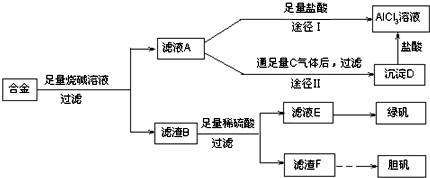
题目内容
现有镁铝铜合金1.2g,加入过量盐酸中,在标准状况下放出氢气1.12L,反应后过滤的沉淀0.2g,若将此合金放入过量的烧碱溶液中,反应在标况下大约能产生多少升氢气?
考点:化学方程式的有关计算
专题:
分析:加盐酸发生Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,反应后过滤的沉淀0.2g,为Cu的质量;将此合金放入过量的烧碱溶液中,发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,以此计算.
解答:
解:由信息可知,Cu为0.2g,设Mg为xmol,Al为ymol,则
Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,
,
解得y=
mol,
将此合金放入过量的烧碱溶液中,发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
则生成气体为
mol×
×22.4L/mol=0.747L,
答:反应在标况下大约能产生0.747升氢气.
Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,
|
解得y=
| 1 |
| 45 |
将此合金放入过量的烧碱溶液中,发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
则生成气体为
| 1 |
| 45 |
| 3 |
| 2 |
答:反应在标况下大约能产生0.747升氢气.
点评:本题考查混合物的计算、根据方程式计算,为高频考点,注意可利用电子转移守恒计算氢气的物质的量或利用反应计算.题目难度不大.

练习册系列答案
相关题目
由硫酸钠,硫酸铁和硫酸组成的混合液中,其c(H+)=0.1mol/L,c(Fe3+)=0.4mol/L,c(SO42-)=0.8mol/L,则c(Na+)为( )
| A、0.3mol/L |
| B、0.15mol/L |
| C、0.2mol/L |
| D、0.4mol/L |
 短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等.下列说法不正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等.下列说法不正确的是( )| A、原子半径:Y>Z>W |
| B、一定条件下,Y可置换出X |
| C、气态氢化物稳定性:Z>W |
| D、熔点YW2>XW4 |
下列事实,不能用勒夏特列原理解释的是( )
| A、实验室用排饱和食盐水而不用排水法收集氯气 |
| B、加催化剂,使N2和H2在一定条件下转化为NH3 |
| C、合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |
| D、光照新制的氯水时,溶液中c(H+)增大 |
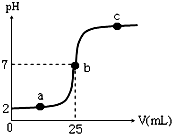 在a mL醋酸溶液中滴加0.01mol?L-1的氢氧化钠溶液,滴定曲线如图所示.
在a mL醋酸溶液中滴加0.01mol?L-1的氢氧化钠溶液,滴定曲线如图所示. 实验室制取乙烯常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.
实验室制取乙烯常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.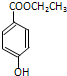 ).
).