题目内容
6.下列说法正确的是( )| A. | BaSO4在熔化状态下导电的本质原因是其中存在自由移动的离子 | |
| B. | 氯化银难溶于水,故其水溶液不导电 | |
| C. | 液态HCl中含有自由移动的Cl- | |
| D. | 电离是电解质在通电的作用下离解成自由移动的离子的过程 |
分析 A.含有自由移动电子或离子的物质能导电;
B.AgCl难溶于水但它是强电解质,在水溶液中能电离出自由移动阴阳离子;
C.HCl为强电解质,在水溶液中能电离出氢离子和氯离子;
D.电离是电解质在水溶液或热熔化的作用下离解成自由移动的离子的过程.
解答 解:A.含有自由移动电子或离子的物质能导电,在熔融状态下硫酸钡能电离出阴阳离子,所以BaSO4在熔化状态下导电的本质原因是其中存在自由移动的离子,故A正确;
B.氯化银虽难溶于水但它是电解质,氯化银电离产生的银离子、氯离子,只是离子的浓度很小,其水溶液导电性极弱,故B错误;
C.液态HCl中只含有HCl分子,不含自由移动的Cl-,故C错误;
D.电离是电解质在水溶液或热熔化的作用下离解成自由移动的离子的过程,所以电解质的电离不需要通电,故D错误;
故选A.
点评 本题考查电解质的电离及物质导电的原因,为高频考点,明确电解质与物质导电关系是解本题关键,电解质不一定导电,但导电的不一定是电解质,注意不能根据电解质的溶解性强弱判断电解质强弱,要根据其电离程度大小判断,易错选项是BD.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
17.下列有关实验的描述不正确的是( )
| A. | 钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同 | |
| B. | 新制饱和氯水和浓硝酸光照下会有气体产生,其成分中有氧气 | |
| C. | 次氯酸和过氧化钠都能使品红溶液褪色,其原理是不相同的 | |
| D. | 灼烧NaOH固体时不能使用瓷坩埚,因为坩埚中的SiO2能与NaOH反应 |
1.合成氨反应为N2+3H2?2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相等)( )
| A. | 恒温恒容:操作1:加1 mol N2+3 molH2,操作2:加2 mol NH3 | |
| B. | 恒温恒压:操作1:加1 mol N2+3 molH2,操作2:加2 mol NH3 | |
| C. | 恒温恒容:操作1:加1 mol N2+3 molH2,操作2:加3 mol NH3 | |
| D. | 恒温恒压:操作1:加1 mol N2+3 molH2,操作2:加3 mol NH3 |
11.下列指定溶液中一定能大量共存的离子组是( )
| A. | pH=1的溶液中:NH4+、Na+、Fe3+、SO42- | |
| B. | 中性溶液中:K+、Fe3+、Cl-、SO42- | |
| C. | AlO2一的浓度为0.1 mol/L的溶液中:K+、Na+、HCO3-、SO42- | |
| D. | Na2S溶液中:SO42-、K+、Cu2+、Cl- |
15.几种短周期元素的原子半径和主要化合价见表:
下列说法正确的是( )
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
| A. | 在化学反应中,M原子既不容易失去电子,又不容易得到电子 | |
| B. | 等物质的量的X、Y的单质与足量盐酸反应,生成的氢气一样多 | |
| C. | Y与Q形成的化合物不可能跟氢氧化钠溶液反应 | |
| D. | Z的氢化物的稳定性强于L的氢化物的稳定性 |
16.下列图示与对应的叙述相符的是( )
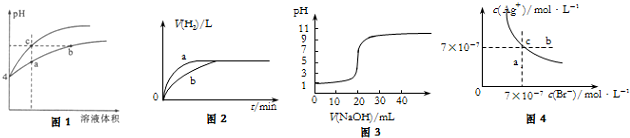

| A. | 图1某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH 变化曲线,用等浓度NaOH溶液分别和等体积b、c处溶液反应,消耗NaOH溶液体积Vb>Vc | |
| B. | 图2中曲线a、b分别表示过量纯锌、过量粗锌(含Cu、C杂质)与同浓度等体积盐酸反应过程中产生H2体积的变化趋势 | |
| C. | 图3表示25℃用0.1000 mol•L-1NaOH溶液滴定20.00mL 0.1000 mol•L-1 CH3COOH溶液得到的滴定曲线 | |
| D. | 图4表示某温度下AgBr在水中的沉淀溶解平衡曲线的图象,向AgBr的饱和溶液中加入NaBr固体,可以使溶液由c点到b点 |