题目内容
18.已知二元酸H2A在水中存在以下电离:H2A═H++HA-,HA-?H++A2-,试回答下列问题:(1)NaHA溶液呈酸(填“酸”“碱”或“中”)性,理由是HA-只电离,不发生水解.
(2)某温度下,向10mL、0.1mol/L NaHA溶液中加入0.1mol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是BD(填写字母).
A.溶液pH=7 B.水的离子积Kw=c2(OH-) C.V=10 D.c(K+)<c(Na+)
分析 (1)由HA-?H++A2-可知,Na2A为强碱弱酸盐;NaHA为酸式盐,H2A第一步完全电离,所以HA-只电离,不发生水解;
(2)A.根据温度判断溶液的pH;
B.中性c(OH-)=c(H+);
C.HA-与 OH-恰好反应时生成A2-,溶液呈碱性,已知溶液为中性,说明NaHA溶液有剩余,故V<10
D.根据C选项判断;
解答 解:(1)由HA-?H++A2-可知,Na2A为强碱弱酸盐;NaHA为酸式盐,H2A第一步完全电离,所以HA-只电离,不发生水解,HA-电离生成氢离子,所以溶液显酸性;
故答案为:酸;HA-只电离,不发生水解;
(2)A.由于温度不知道,故中性时溶液pH不能确定,故A错误;
B.中性c(OH-)=c(H+),Kw=c(OH-)•c(H+)=KW=c2(OH-),故B正确;
C.HA-与 OH-恰好反应时生成A2-,溶液呈碱性,已知溶液为中性,说明NaHA溶液有剩余,故V<10,故C错误;
D.根据C选项判断,NaHA过量,所以c(K+)<c(Na+),故D正确;
故答案为:BD.
点评 本题考查弱电解质的电离,注意题干信息中H2A的两步电离不同,第一步完全电离、第二步部分电离,导致HA-只电离不水解,为易错题.

练习册系列答案
相关题目
9.现有物质的量浓度均为0.1mol•L-1的四种溶液各25mL:①氨水 ②NH4Cl溶液 ③Na2CO3溶液 ④NaHCO3溶液,下列说法正确的是( )
| A. | 4种溶液pH的大小顺序:①>④>③>② | |
| B. | ①、②混合后pH>7,则混合溶液中c(NH4+)<c(NH3•H2O) | |
| C. | ①、②中分别加入25mL0.1mol•L-1盐酸后,溶液中c(NH4+):①>② | |
| D. | ③、④中分别加入12.5mL0.1mol•L-1NaOH溶液后,两溶液中离子种类相同 |
6.下列说法正确的是( )
| A. | BaSO4在熔化状态下导电的本质原因是其中存在自由移动的离子 | |
| B. | 氯化银难溶于水,故其水溶液不导电 | |
| C. | 液态HCl中含有自由移动的Cl- | |
| D. | 电离是电解质在通电的作用下离解成自由移动的离子的过程 |
10.现有下列四个转化,其中不可能通过一步反应实现的是( )
①SiO2→Na2SiO3 ②CuSO4→CuCl2 ③SiO2→H2SiO3 ④CuO→Cu(OH)2.
①SiO2→Na2SiO3 ②CuSO4→CuCl2 ③SiO2→H2SiO3 ④CuO→Cu(OH)2.
| A. | ①② | B. | ③④ | C. | ②③ | D. | ②③④ |
8.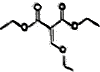 乙氧基甲叉丙二酸二乙酯是有机合成原料,用于医药、染料等产品制造,其结构简式如图所示,下列有关叙述错误的是( )
乙氧基甲叉丙二酸二乙酯是有机合成原料,用于医药、染料等产品制造,其结构简式如图所示,下列有关叙述错误的是( )
 乙氧基甲叉丙二酸二乙酯是有机合成原料,用于医药、染料等产品制造,其结构简式如图所示,下列有关叙述错误的是( )
乙氧基甲叉丙二酸二乙酯是有机合成原料,用于医药、染料等产品制造,其结构简式如图所示,下列有关叙述错误的是( )| A. | 乙氧基甲叉丙二酸的化学式为C6H6O5 | |
| B. | 1mol乙氧基甲叉丙二酸二乙酯在酸性条件下水解得到1mol乙醇 | |
| C. | 1mol乙氧基甲叉丙二酸最多能消耗2molNaOH | |
| D. | 乙氧基甲叉丙二酸既能发生取代反应又能发生氧化反应 |
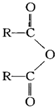 $\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)
$\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)
 ,CH2=C(CH3)CH=CH2.
,CH2=C(CH3)CH=CH2. ;
; ;
; ;
; ;
; ;
; ;
;