题目内容
11.下列指定溶液中一定能大量共存的离子组是( )| A. | pH=1的溶液中:NH4+、Na+、Fe3+、SO42- | |
| B. | 中性溶液中:K+、Fe3+、Cl-、SO42- | |
| C. | AlO2一的浓度为0.1 mol/L的溶液中:K+、Na+、HCO3-、SO42- | |
| D. | Na2S溶液中:SO42-、K+、Cu2+、Cl- |
分析 A.pH=1的溶液,显酸性;
B.中性溶液中不能大量存在Fe3+;
C.AlO2-促进HCO3-的电离;
D.离子之间结合生成沉淀.
解答 解:A.pH=1的溶液,显酸性,该组离子之间不反应,可大量共存,故A正确;
B.中性溶液中不能大量存在Fe3+,故B错误;
C.AlO2-促进HCO3-的电离,不能大量共存,故C错误;
D.S2-、Cu2+结合生成沉淀,不能大量共存,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.如图甲所示,纯电动公交车逐渐成为杭州街头常见的身影,磷酸铁锂电池是一种常用于纯电动公交车的电池,其原理如图乙所示.充电时,左侧接电源正极,右侧接负极,总反应式为:LiFePO4+6C=Li1-xFePO4+LixC6,下列说法不正确的是( )
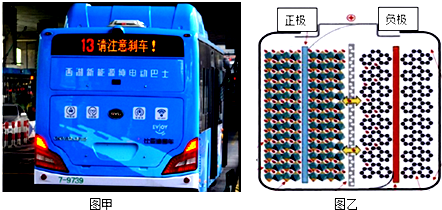

| A. | 充电时阳极反应可表示为LiFePO4-xe-=Li1-xFePO4+xLi+ | |
| B. | 充电时阴极反应可表示为xLi++xe-+6C=LixC6 | |
| C. | 放电时负极反应可表示为LixC6-xe-=xLi++6C | |
| D. | 放电时Li+从左向右通过离子交换膜 |
19.下列叙述正确的是(NA表示阿伏加德罗常数值)( )
| A. | 1molC60F60分子中非极性共价键数目为60NA | |
| B. | 2.1gDTO分子中所含中子数为NA | |
| C. | 4.6gN2O4和NO2混合物中含的电子数为2.3NA | |
| D. | aml1mol/L的H2B溶液中,测得溶液中无H2B分子,则溶液中阴离子数为aNA |
6.下列说法正确的是( )
| A. | BaSO4在熔化状态下导电的本质原因是其中存在自由移动的离子 | |
| B. | 氯化银难溶于水,故其水溶液不导电 | |
| C. | 液态HCl中含有自由移动的Cl- | |
| D. | 电离是电解质在通电的作用下离解成自由移动的离子的过程 |
16.将1LpH=13 的氨水溶液加入水稀释到10.0L后,下列微粒浓度增大的是( )
| A. | c[NH3•H2O] | B. | c[H+] | C. | c[OH-] | D. | c[NH4+] |
1.常温下,用0.1mol•L-1的CH3COOH溶液滴定20mL 0.1mol•L-1的NaOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7.已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,下列关系式正确是( )
| A. | Ka=$\frac{2×1{0}^{-7}}{0.1V-2}$ | B. | V=$\frac{2×1{0}^{-7}}{0.1{K}_{a}-2}$ | ||
| C. | Ka=$\frac{2×1{0}^{-7}}{V+20}$ | D. | Ka=$\frac{2×1{0}^{-8}}{V}$ |
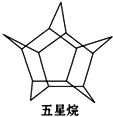 化学家合成了一种新物质-五星烷,它的分子立体结构如图所示:
化学家合成了一种新物质-五星烷,它的分子立体结构如图所示: