题目内容
14.某温度下,将氢气和碘蒸气各1mol的气态混合物充入10L的密闭容器中.发生反应H2(g)+I2(g)=2HI(g).2分钟后达到平衡后.测得C(H2)=0.08mol•L-1,求(1)该反应的平衡常数.
(2)2分钟内的H2的反应速率.
分析 (1)依据化学平衡的三段式列式计算物质的平衡浓度,结合平衡常数概念计算得到;
(2)反应前氢气的浓度为:$\frac{1mol}{10L}$0.10mol/L,根据v(H2)=$\frac{△c}{△t}$计算出2分钟内的H2的反应速率.
解答 解:(1)在某温度下,将H2和I2各1mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后测得c(H2)=0.08mol/L,
H2 +I2 ?2HI
起始量(mol/L) 0.10 0.10 0
变化量(mol/L) 0.02 0.02 0.04
平衡量(mol/L) 0.08 0.08 0.04
则该温度下该反应的平衡常数为:K=$\frac{0.0{4}^{2}}{0.08×0.08}$=0.25;
答:该反应的平衡常数为0.25;
(2)达到平衡后测得c(H2)=0.08mol/L,反应前氢气的浓度为:$\frac{1mol}{10L}$0.10mol/L,则2min内氢气的平均反应速率为:v(H2)=$\frac{0.10mol/L-0.08mol.L}{2min}$=0.01mol/(L•min),
答:2分钟内氢气的平均反应速率为0.01mol/(L•min).
点评 本题考查了化学平衡常数的计算,题目难度中等,明确化学平衡常数、化学反应速率的概念及表达式为解答关键,注意掌握三段式在化学计算中的应用,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
5.下表是元素周期表的一部分.
根据A~H元素在周期表中的位置,用化学式填写空白.
(1)氧化性最强的单质是F2,还原性最强的单质是Na,化学性质最不活泼的单质是Ne.(填相应的化学式)
(2)最稳定的氢化物是HF.(填相应的化学式)
(3)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是NaOH、Al(OH)3、H3PO4、HClO4.(填相应的化学式)
(4)一个E原子的核外电子总共有15种运动状态.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | F | H | |||||
| 3 | B | C | E | G |
(1)氧化性最强的单质是F2,还原性最强的单质是Na,化学性质最不活泼的单质是Ne.(填相应的化学式)
(2)最稳定的氢化物是HF.(填相应的化学式)
(3)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是NaOH、Al(OH)3、H3PO4、HClO4.(填相应的化学式)
(4)一个E原子的核外电子总共有15种运动状态.
2.已知R2+离子核外有a个电子,b个中子.表示R原子组成正确的是( )
| A. | ${\;}_{a}^{b}$ R | B. | ${\;}_{a-2}^{a+b-2}$ R | C. | ${\;}_{a+2}^{a+b+2}$ R | D. | ${\;}_{a-2}^{a+b}$ R |
9.A、B两种非金属元素:①A比B容易与H2化合;②A原子能与B阴离子发生置换反应;③A的最高价氧化物对应水化物的酸性比B的最高价氧化物对应水化物的酸性强;④与某金属反应时,A原子得电子数目比B多;⑤A单质熔、沸点比B单质低.能说明A比B非金属性强的是( )
| A. | 只有①② | B. | 只有①②③④ | C. | 只有①②③ | D. | 全部 |
19.下列说法正确的是( )
| A. | 0.1mol•L-1的醋酸加水稀释,$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 | |
| C. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量)后者用时少 | |
| D. | 常温下,V1L pH=11的NaOH溶液与V2L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
6.在一个氧化还原反应的体系中,共有SO2、O2、Fe2O3、FeS2四种物质.在反应中测得O2和Fe2O3的物质的量随时间变化如图所示.下列有关判断中正确的是( )

| A. | O2中只存在非极性共价键,SO2是共价化合物 | |
| B. | 氧化剂是O2,还原产物只有Fe2O3 | |
| C. | 每消耗22.4LO2,即转移4NA个电子 | |
| D. | SO2溶于水之后的溶液可以导电,所以SO2是电解质 |
4.实验室用浓硫酸和乙醇反应制备乙烯,若温度过高或加热时间过长,制得的乙稀往往混有CO2、SO2、H2O(气体少量).请回答下列问题:
(1)试分析CO2和SO2 是怎么样产生的?乙醇或乙烯与浓硫酸发生氧化还原反应生成CO2和SO2(用一句话说明).
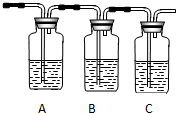
(2)试用如图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g),按气流的方向,各装置的连接顺序是:④②①③.
(3)实验时若观察到:①中A瓶中溶液褪色,B瓶中溶液颜色逐渐变浅,C瓶中溶液不褪色,则C瓶的作用是检验SO2是否除尽.
(4)装置②中所加的试剂名称是无水硫酸铜,简述确定装置②在整套装置中的位置的理由是①③导出的气体带有水蒸气,影响水蒸气的确定.
(1)试分析CO2和SO2 是怎么样产生的?乙醇或乙烯与浓硫酸发生氧化还原反应生成CO2和SO2(用一句话说明).
(2)试用如图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g),按气流的方向,各装置的连接顺序是:④②①③.
 品红溶液 KMnO4 溶液品红溶液 品红溶液 KMnO4 溶液品红溶液 ① |  ② ② | 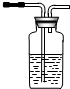 ③ | 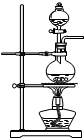 ④ |
(4)装置②中所加的试剂名称是无水硫酸铜,简述确定装置②在整套装置中的位置的理由是①③导出的气体带有水蒸气,影响水蒸气的确定.