题目内容
2.已知R2+离子核外有a个电子,b个中子.表示R原子组成正确的是( )| A. | ${\;}_{a}^{b}$ R | B. | ${\;}_{a-2}^{a+b-2}$ R | C. | ${\;}_{a+2}^{a+b+2}$ R | D. | ${\;}_{a-2}^{a+b}$ R |
分析 阳离子中质子数=核外电子数+电荷数,质量数=质子数+中子数,表示核素的原子符号应写出质子数和质量数.
解答 解:R2+离子核外有a个电子,阳离子中质子数=核外电子数+电荷数=a+2,质量数=质子数+中子数=a+2+b,所以R原子符号为 ${\;}_{a+2}^{a+b+2}$ R,
故选C.
点评 本题考查了质子数、中子数和质量数之间的关系,难度不大,会阴阳离子中核外电子数的计算方法是解本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
12.如图,A、B、C、D、E是长式元素周期表中的5种元素(不包括镧系和锕系).下列说法不正确的是( )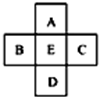

| A. | A、E原子序数之差可能为2 | B. | D、E原子序数之差可能是8、18或32 | ||
| C. | B、C原子序数之差一定是2 | D. | B、D原子序数之差不可能是7 |
13.下列关于糖类、蛋白质、油脂和维生素的说法中,正确的是( )
| A. | 它们的组成都含有C、H、O、N等元素 | |
| B. | 油脂都是高级脂肪酸的甘油酯,是一种高热量营养素 | |
| C. | 人体需要的二十多种氨基酸,都可以通过人体自身合成 | |
| D. | 在一定条件下,它们都能发生水解反应 |
17.下列热化学方程式中的反应热(括号内)表示燃烧热的是( )
| A. | NH3(g)+$\frac{5}{4}$O2(g)═NO(g)+$\frac{6}{4}$H2O(g);△H=-akJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-bkJ•mol-1 | |
| C. | 2CO(g)+O2(g)═2CO2(g);△H=-ckJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)═CH3CHO(l)+H2O(l);△H=-dkJ•mol-1 |
7.现有几组物质的熔点(℃)数据:
据此回答下列问题:
(1)A组属于原子晶体,其熔化时克服的微粒间的作用力是共价键.
(2)C组中HF熔点反常是由于HF分子间能形成氢键,其熔化时需要消耗的能量更多.
(3)D组晶体可能具有的性质是②④(填序号).
①硬度非常高 ②水溶液能导电 ③固体能导电 ④熔融状态能导电.
| A组 | B组 | C组 | D组 |
| 金刚石:3 550℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶体:1 410℃ | Na:98℃ | HCl:-115℃ | KCl:776℃ |
| 硼晶体:2 300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅:1 723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
(1)A组属于原子晶体,其熔化时克服的微粒间的作用力是共价键.
(2)C组中HF熔点反常是由于HF分子间能形成氢键,其熔化时需要消耗的能量更多.
(3)D组晶体可能具有的性质是②④(填序号).
①硬度非常高 ②水溶液能导电 ③固体能导电 ④熔融状态能导电.
12.下列反应过程中的能量变化情况符合图的是( )


| A. | 酸与碱的中和反应 | B. | 石灰石高温分解反应 | ||
| C. | 镁和盐酸的反应 | D. | 氧化钙和水的反应 |
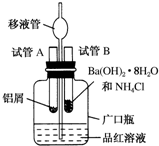 某研究性学习小组为了探究化学能与热能之间的转化,设计了以下实验装置并按如下操作进行实验:
某研究性学习小组为了探究化学能与热能之间的转化,设计了以下实验装置并按如下操作进行实验:
