题目内容
25℃时,0.1mol/L稀醋酸加水稀释,如图中的纵坐标y可以是( )
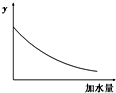

| A、溶液的pH |
| B、醋酸的电离平衡常数 |
| C、醋酸的电离程度 |
| D、溶液的导电能力 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,溶液的导电能力与离子浓度成正比,温度不变,醋酸的电离平衡常数不变,据此分析解答.
解答:
解:A.醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,所以溶液中氢离子浓度逐渐减少,溶液的pH逐渐增大,但始终小于7,故A错误;
B.温度不变,醋酸的电离平衡常数不变,故B错误;
C.加水稀释促进醋酸电离,则醋酸的电离程度增大,故C错误;
D.醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,所以溶液中氢离子、醋酸根离子浓度逐渐减少,溶液的导电能力逐渐减小,故D正确;
故选D.
B.温度不变,醋酸的电离平衡常数不变,故B错误;
C.加水稀释促进醋酸电离,则醋酸的电离程度增大,故C错误;
D.醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,所以溶液中氢离子、醋酸根离子浓度逐渐减少,溶液的导电能力逐渐减小,故D正确;
故选D.
点评:本题考查了弱电解质的电离,明确加水稀释对醋酸电离程度的影响是解本题关键,知道溶液导电能力与离子浓度成正比,与电解质强弱无关,为易错点.

练习册系列答案
相关题目
已知25℃,AgI饱和溶液中Ksp=1.22×10-8mol/L,AgCl饱和溶液中,c(Ag+)=1.25×10-5mol/L,若在5ml含有KCl和KI各为0.01mol/L的溶液中加入8mL0.01mol/L的AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( )
| A、c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
| B、c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| C、c(NO3-)>c(K+)>c(Ag+)>c (Cl-)>c(I-) |
| D、c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) |
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)?M(g)+N(g),所得实验数据如下表:下列说法正确的是( )
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
| A、实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol?L-1?min-1 |
| B、实验②中,该反应的平衡常数K=2.0 |
| C、实验③中,达到平衡时,X的转化率为40% |
| D、实验④中,达到平衡时,b<0.060 |
下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
| A、2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l);△H=-11036kJ/mol | ||
B、C(s)+
| ||
C、H2(g)+
| ||
D、CO(g)+
|
下列叙述正确的是( )
| A、两原子如果核外电子排布相同,则一定属于同种元素 |
| B、同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| C、ⅠA族与ⅦA族元素间只能形成离子化合物 |
| D、非金属元素形成的共价化合物中,原子的最外层都达到了8电子的稳定结构 |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、50mL 18.4mol?L-1浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
| B、常温常压下,4.6gNO2与N2O4混合气中含有0.3NA个原子 |
| C、1L0.1mol?L-1Na2CO3溶液中含有的阴离子数为0.1NA |
| D、标准状况下,22.4LCCl4中含有NA个分子 |