题目内容
已知25℃,AgI饱和溶液中Ksp=1.22×10-8mol/L,AgCl饱和溶液中,c(Ag+)=1.25×10-5mol/L,若在5ml含有KCl和KI各为0.01mol/L的溶液中加入8mL0.01mol/L的AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( )
| A、c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
| B、c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| C、c(NO3-)>c(K+)>c(Ag+)>c (Cl-)>c(I-) |
| D、c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) |
考点:离子浓度大小的比较
专题:
分析:二者混合时,根据溶度积常数知,先生成AgI,再生成AgCl,AgNO3+KI═AgI↓+KNO3,n(KI)=0.01mol?L-1×5 mL=5.0×10-5 mol,消耗n(AgNO3)=5.0×10-5mol,后发生AgNO3+KCl═AgCl↓+KNO3,过量的AgNO3为0.01 mol?L-1×8 mL-5.0×10-5 mol=3.0×10-5 mol,而KCl为n(KCl)=0.01mol?L-1×5 mL=5.0×10-5 mol,则KCl过量,生成AgCl为3.0×10-5 mol,由此得出反应后溶液中的溶质为KNO3、KCl,生成AgCl、AgI沉淀,据此分析解答.
解答:
解:二者混合时,根据溶度积常数知,先生成AgI,再生成AgCl,AgNO3+KI═AgI↓+KNO3,n(KI)=0.01mol?L-1×5 mL=5.0×10-5 mol,消耗n(AgNO3)=5.0×10-5mol,后发生AgNO3+KCl═AgCl↓+KNO3,过量的AgNO3为0.01 mol?L-1×8 mL-5.0×10-5 mol=3.0×10-5 mol,而KCl为n(KCl)=0.01mol?L-1×5 mL=5.0×10-5 mol,则KCl过量,生成AgCl为3.0×10-5 mol,由此得出反应后溶液中的溶质为KNO3、KCl,生成AgCl、AgI沉淀,
溶液中钾离子、硝酸根离子不参加反应,根据物料守恒得c(K+)>c(NO3-),氯离子有剩余,所以其次是氯离子浓度较大,氯离子抑制碘化银溶解,所以碘离子浓度最小,所以离子浓度大小顺序是c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-),
故选A.
溶液中钾离子、硝酸根离子不参加反应,根据物料守恒得c(K+)>c(NO3-),氯离子有剩余,所以其次是氯离子浓度较大,氯离子抑制碘化银溶解,所以碘离子浓度最小,所以离子浓度大小顺序是c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-),
故选A.
点评:本题考查离子浓度大小比较,侧重考查物质之间反应、难溶物的溶解平衡等知识点,明确混合溶液中的溶质采用物料守恒分析解答,题目难度中等.

练习册系列答案
相关题目
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示),下列有关说法正确的是( )

| A、第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序可以为、NaOH溶液BaCl2溶液,碳酸钠溶液,过滤后加盐酸 |
| B、第②步中结晶出的MgCl2?6H2O可在蒸发皿中加热制无水MgCl2 |
| C、在第④步中的反应离子方程式为Br2+SO2+2H2O=2H++SO42-+2HBr |
| D、第⑤步涉及的分离操作有过滤、萃取、蒸馏 |
下列分子中含有手性碳原子的是( )
| A、CF2Cl2 |
| B、CH3CH2OH |
C、 |
| D、CH2═CH-COOH |
将1L含有0.4molCuSO4和0.2molNaCl的水溶液用惰性电极电解,电解一段时间后,在一个电极上增重19.2g,另一个电极上产生气体(标况)的体积是( )
| A、4.48L |
| B、5.6L |
| C、6.72L |
| D、13.44L |
25℃时,0.1mol/L稀醋酸加水稀释,如图中的纵坐标y可以是( )
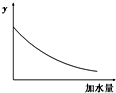

| A、溶液的pH |
| B、醋酸的电离平衡常数 |
| C、醋酸的电离程度 |
| D、溶液的导电能力 |
下列有关化学用语的表示正确的是( )
| A、HClO的结构式:H-Cl-O |
| B、硝基和二氧化氮两种粒子所含电子数相等 |
C、甲烷分子的比例模型是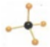 |
D、甲基的电子式: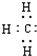 |




