题目内容
6.室温下,在pH=0的酸性溶液中能大量共存,且溶液无无色透明的离子组是( )| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Na+、ClO-、NH4+ | ||
| C. | K+、NH4+、MnO4-、SO42- | D. | Na+、K+、NO3-、HSO3- |
分析 pH=0的酸性溶液含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水、弱电解质等,不能发生氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
解答 解:pH=0的酸性溶液含大量的氢离子,
A.该组离子之间不反应,可大量共存,且离子均为无色,故A选;
B.酸溶液中不能大量存在ClO-,故B不选;
C.MnO4-为紫色,与无色不符,故C不选;
D.H+、NO3-、HSO3-发生氧化还原反应,不能大量共存,故D不选;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
16.在一定条件下的恒温恒容容器中,当下列物理量不再发生变化时,反应:2A(g)+B(g)?3C(g)+D(s)不能表明已达平衡状态的是( )
| A. | B的体积分数 | B. | 气体平均相对分子质量 | ||
| C. | 气体的总压强 | D. | 混合气体的密度 |
17.碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如图.下列有关该物质的说法正确的是( )
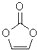

| A. | 1mol该物质最多可与2molH2加成 | B. | 分子式为C3H2O3 | ||
| C. | 分子中只有极性键 | D. | 8.6g该物质完全燃烧得到6.72LCO2 |
11.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 向30mL0.1mol•L-1NaOH溶液滴加20mL0.1mol•L-1H2C2O4溶液后:3c(Na+)=2[c(HC2O${\;}_{4}^{-}$)+c(C2O${\;}_{4}^{2-}$)+c(H2C2O4)] | |
| B. | 将同浓度的CH3COONa溶液和HCl溶液按照体积比2:1混合,混合后溶液呈酸性:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 向NH4HSO4溶液中加入NaOH至中性:c(Na+)>c(SO${\;}_{4}^{2-}$)═c(NH${\;}_{4}^{+}$) | |
| D. | 常温下将pH为3的CH3COOH溶液与pH为11的NaOH溶液等体积混合,所得溶液中:c(OH-)=c(H+)+c(CH3COOH) |
18.下列说法错误的是( )
| A. | 常温下,0.1mol•L-1的CH3COOH溶液中,由水电离出的c(H+)为1.0×10-13mol•L-1 | |
| B. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| C. | 常温下,等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液的pH<7 | |
| D. | 25℃时,完全中和50mLpH=3的H2SO4溶液,需要pH=11的NaOH溶液50mL |
15.将c(H+)为10-2mol/L的醋酸和盐酸溶液分别加水稀释100倍,得两溶液的c(H+)分别为a和b,则a和b的关系是( )
| A. | a>b | B. | a<b | C. | a=b | D. | 无法确定 |
19.属于同分异构体的是( )
| A. | O2和O3 | B. | 2H2和3H2 | ||
| C. | H2O与H2O2 | D. | C2H5COOH与CH3COOCH3 |
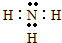
 ,其中含有的化学键有共价键、离子键,属于离子 晶体
,其中含有的化学键有共价键、离子键,属于离子 晶体