题目内容
15.将c(H+)为10-2mol/L的醋酸和盐酸溶液分别加水稀释100倍,得两溶液的c(H+)分别为a和b,则a和b的关系是( )| A. | a>b | B. | a<b | C. | a=b | D. | 无法确定 |
分析 醋酸为弱酸,则c(H+)=10-2mol?L-1的醋酸和盐酸,醋酸浓度大于盐酸,分别稀释100倍时,HCl完全电离,醋酸的电离程度增大,导致稀释后溶液中c(H+)都减小,但盐酸中氢离子浓度变化更大,据此分析解答.
解答 解:c(H+)=10-2mol?L-1的醋酸和盐酸,由于醋酸为弱酸,则醋酸浓度大于盐酸,
将两溶液分别稀释100倍后,HCl完全电离,而醋酸的电离程度增大,则稀释后溶液中c(H+)都减小,但醋酸浓度减小程度小于盐酸,所以稀释后c(H+)醋酸大于盐酸,即:a>b,
故选A.
点评 本题考查弱电解质的电离及其影响,题目难度不大,明确弱电解质电离影响因素是解本题关键,注意加水稀释虽然促进醋酸电离,但溶液中氢离子浓度仍然减小,为易错点,试题培养了学生的灵活应用能力.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
5.短周期主族元素A、B、C、D的原子序数依次增大,A、B、C原子的最外层电子数之和为12,B、C、D位于同一周期,C原子的最外层电子数既是A原子内层电子数的3倍又是B原子最外层电子数的3倍.下列说法正确的是( )
| A. | 原子半径:B>A,离子半径C<D | |
| B. | B的单质能与A的最高价氧化物发生置换反应 | |
| C. | 元素B和D能形成BD2型的共价化合物 | |
| D. | D的单质有毒,且干燥的单质D有漂白性 |
6.室温下,在pH=0的酸性溶液中能大量共存,且溶液无无色透明的离子组是( )
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Na+、ClO-、NH4+ | ||
| C. | K+、NH4+、MnO4-、SO42- | D. | Na+、K+、NO3-、HSO3- |
10.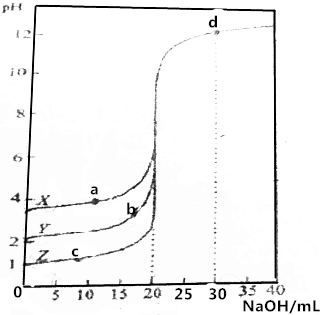 用0.1000mol•L-1的NaOH溶液分别滴定0.1000mol•L-1、20.00mLX、Y、Z三种酸溶液.溶液pH与加入NaOH体积之间的关系如图所示,下列说法错误的是( )
用0.1000mol•L-1的NaOH溶液分别滴定0.1000mol•L-1、20.00mLX、Y、Z三种酸溶液.溶液pH与加入NaOH体积之间的关系如图所示,下列说法错误的是( )
 用0.1000mol•L-1的NaOH溶液分别滴定0.1000mol•L-1、20.00mLX、Y、Z三种酸溶液.溶液pH与加入NaOH体积之间的关系如图所示,下列说法错误的是( )
用0.1000mol•L-1的NaOH溶液分别滴定0.1000mol•L-1、20.00mLX、Y、Z三种酸溶液.溶液pH与加入NaOH体积之间的关系如图所示,下列说法错误的是( )| A. | Z为一元强酸 | |
| B. | d点的c(OH-)为0.02000mol•L-1 | |
| C. | a、b、c中b点的阴离子的物质的量浓度最大 | |
| D. | X、Y为一元弱酸,且其电离常数:Ka(x)<Ka(Y) |
7.下列有关“燃烧”的叙述不正确的是( )
| A. | 燃烧是发光、发热的化学反应 | B. | 燃烧必须有02参加 | ||
| C. | 燃烧必须有H20参加 | D. | 燃烧一定是氧化还原反应 |
7. 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1的HCl标准溶液进行中和滴定(用甲基橙作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1的HCl标准溶液进行中和滴定(用甲基橙作指示剂).
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为锥形瓶.
(2)盛装标准盐酸的仪器名称为酸式滴定管.
(3)滴定至终点的颜色变化为溶液由黄色变为橙色且半分钟内不褪色.
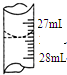
(4)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为26.90mL.
(5)乙学生做了三组平行实验,数据记录如下:
选取下述合理数据,计算出待测NaOH溶液的物质的量浓度为0.1052mol/L (保留四位有效数字).
(6)下列哪些操作会使测定结果偏高AC(填序号).
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.
 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1的HCl标准溶液进行中和滴定(用甲基橙作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1的HCl标准溶液进行中和滴定(用甲基橙作指示剂).请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为锥形瓶.
(2)盛装标准盐酸的仪器名称为酸式滴定管.
(3)滴定至终点的颜色变化为溶液由黄色变为橙色且半分钟内不褪色.
(4)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为26.90mL.
(5)乙学生做了三组平行实验,数据记录如下:
选取下述合理数据,计算出待测NaOH溶液的物质的量浓度为0.1052mol/L (保留四位有效数字).
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.29 |
| 2 | 25.00 | 1.00 | 31.00 |
| 3 | 25.00 | 1.00 | 27.31 |
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.
8.下列物质不属于有机合成材料的是( )
| A. | 塑料瓶 | B. | 不锈钢 | C. | 涤纶布料 | D. | 合成纤维 |
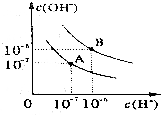 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: