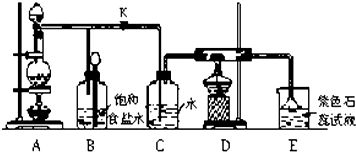
题目内容
14.已知X、Y、Z、W四种元素分布在元素周期表中的三个不同短周期元素里,且原子序数依次增大.X、W同主族,Y、Z为同周期的相邻元素.W原子的质子数等于Y、Z原子最外层电子数之和.Y的氢化物分子中有3个共价键.Z原子最外层电子数是次外层电子数的3倍.试推断:(1)X、Y、Z、W四种元素的名称分别为:XH、YN、ZO、WNa
(2)Y与Z形成的化合物的电子式为
(3)W在元素周期表中的位置是第三周期IA族;W的最高价氧化物的水化物电子式为
 ,其中含有的化学键有共价键、离子键,属于离子 晶体
,其中含有的化学键有共价键、离子键,属于离子 晶体(4)由X、Y、Z所形成的属于强电解质的共价化合物的化学式是HNO3,它与W的最高氧化物的水化物的溶液反应时的离子方程式:H++OH-=H2O.
分析 已知X、Y、Z、W四种元素分布在元素周期表中的三个不同短周期元素里,且原子序数依次增大;Z原子最外层电子数是次外层电子数的3倍,Z原子只能有2个电子层,最外层电子数为6,则Z为O元素;Y的氢化物分子中有3个共价键,原子序数小于O元素,则Y应为N元素;W原子的质子数等于Y、Z原子最外层电子数之和,W原子质子数=5+6=11,则W为Na元素,X、W同主族,且X原子序数最小,结合四元素是连续三个不同短周期的元素,则X为H元素,据此进行解答.
解答 解:(1)已知X、Y、Z、W四种元素分布在元素周期表中的三个不同短周期元素里,且原子序数依次增大;Z原子最外层电子数是次外层电子数的3倍,Z原子只能有2个电子层,最外层电子数为6,则Z为O元素;Y的氢化物分子中有3个共价键,原子序数小于O元素,则Y应为N元素;W原子的质子数等于Y、Z原子最外层电子数之和,W原子质子数=5+6=11,则W为Na元素,X、W同主族,且X原子序数最小,结合四元素是连续三个不同短周期的元素,则X为H元素,
(1)根据以上分析可知,X为H元素、Y为N、Z为O、W为Na元素,
故答案为:H;N;O;Na;
(2)由H、N形成的化合物为NH3,其电子式为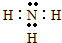 ;
;
故答案为: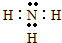 ;
;
(3)W为Na元素,在周期表中为第三周期、第IA族;Na的最高价氧化物的水化物为NaOH,其电子式为: ;NaOH中含有共价键和离子键,属于离子晶体;
;NaOH中含有共价键和离子键,属于离子晶体;
故答案为:第三周期IA族; ;共价键和离子键;离子;
;共价键和离子键;离子;
(4)由H、N、O所形成的常见共价化合物为HNO3,与NaOH反应生成硝酸钠和水,其反应的离子方程式为:H++OH-=H2O;
故答案为:HNO3;H++OH-=H2O.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,试题综合考查学生分析问题的能力,正确推断各元素为解答关键,注意掌握电子式的书写以及相关物质的性质,为易错点.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案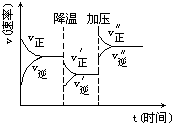 图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )| A. | A、B、C、D均为气体 | B. | 若A、B是气体,则C、D是液体或固体 | ||
| C. | 逆反应是放热反应 | D. | 在整个过程中,A的转化率一直增大 |
| A. | 原子半径:B>A,离子半径C<D | |
| B. | B的单质能与A的最高价氧化物发生置换反应 | |
| C. | 元素B和D能形成BD2型的共价化合物 | |
| D. | D的单质有毒,且干燥的单质D有漂白性 |
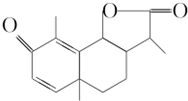 从菊科植物茼蒿的花中提取的一种有机化合物可用作驱肠虫剂,其结构简式如图所示.下列判断正确的是( )
从菊科植物茼蒿的花中提取的一种有机化合物可用作驱肠虫剂,其结构简式如图所示.下列判断正确的是( )| A. | 该有机化合物的分子式为C14H15O3 | B. | 该有机化合物含有两种官能团 | ||
| C. | 该有机化合物是芳香烃的衍生物 | D. | 该有机化合物可看作环状化合物 |
| A. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| B. | 含有大量NH4+的溶液:Mg2+、S2-、OH-、I- | |
| C. | 通有足量NO2的溶液:K+、Na+、SO32-、AlO2- | |
| D. | 强酸性溶液中:Na+、Fe3+、NO3-、SO42- |
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Na+、ClO-、NH4+ | ||
| C. | K+、NH4+、MnO4-、SO42- | D. | Na+、K+、NO3-、HSO3- |
 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1的HCl标准溶液进行中和滴定(用甲基橙作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1的HCl标准溶液进行中和滴定(用甲基橙作指示剂).请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为锥形瓶.
(2)盛装标准盐酸的仪器名称为酸式滴定管.
(3)滴定至终点的颜色变化为溶液由黄色变为橙色且半分钟内不褪色.
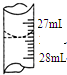
(4)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为26.90mL.
(5)乙学生做了三组平行实验,数据记录如下:
选取下述合理数据,计算出待测NaOH溶液的物质的量浓度为0.1052mol/L (保留四位有效数字).
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.29 |
| 2 | 25.00 | 1.00 | 31.00 |
| 3 | 25.00 | 1.00 | 27.31 |
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.