题目内容
17.下列离子方程式书写正确的是( )| A. | 铝粉投入到冷浓硝酸中:2Al+6H+=2Al3++3H2↑ | |
| B. | 铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 用小苏打治疗胃酸过多:H++HCO3-=H2O+CO2↑ | |
| D. | Ba(OH)2与稀H2SO4反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
分析 A.铝粉投入到冷浓硝酸发生钝化;
B.不符合反应客观事实;
C.小苏打为碳酸氢钠,与盐酸反应生成氯化钠和水、二氧化碳;
D.离子个数配比不符合物质构成.
解答 解:A.铝粉投入到冷浓硝酸发生钝化,阻止反应进行,故A错误;
B.铁与盐酸反应,离子方程式:Fe+2H+=Fe2++H2↑,故B错误;
C.用小苏打治疗胃酸过多,离子方程式:H++HCO3-=H2O+CO2↑,故C正确;
D.Ba(OH)2与稀H2SO4反应,离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意反应物用量对反应的影响,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.设NA为阿佛加德罗常数,下列叙述中正确的是( )
| A. | 标准状况下,22.4L水所含有的原子数目为3NA | |
| B. | 标准状况下,22.4 L H2中含质子数为2NA | |
| C. | 0.1mol•L-1稀硫酸100mL中含有硫酸根个数为0.1NA | |
| D. | 0.1molOH-含NA个电子 |
5.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 68g KHSO4晶体中含有SO42-的数目为0.5NA | |
| B. | 把含0.1molFeCl3的浓溶液加入沸水中形成0.1NA个氢氧化铁胶粒 | |
| C. | 标况下2.24L丙烯分子中含有的共用电子对数目为0.9NA | |
| D. | 把5mL 11.2mol/L的浓盐酸与足量的MnO2固体混合,加热充分反应后,把产生的气体完全溶于水时,转移电子的数目为0.014NA |
12.下列混合物中,用分液漏斗不能分离的是( )
| A. | 酒精和水 | B. | 汽油和水 | C. | 苯和水 | D. | 四氯化碳和水 |
6.100mL 6mol/L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A. | 碳酸钠(固体) | B. | 水 | C. | 稀盐酸 | D. | 硫酸铵(固体) |
12.如表是元素周期表的一部分,回答下列有关问题:
(1)写出②的离子结构示意图 ①的气态氢化物的电子式
①的气态氢化物的电子式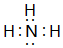 .
.
(2)写出⑪元素基态原子的价电子排布式4s2.
(3)在这些元素的最高价氧化物对应水化物中,有一种呈两性的用来治疗胃酸过多反应的离子方程式:Al(OH)3+3H+=Al3++3H2O.
(4)在这些元素中,某元素的最高价氧化物对应的水化物可以和其气态氢化物反应,写出该反应化学方程式NH3+HNO3=NH4NO3或 2H2S+H2SO4(浓)=3H2O+2S+SO2.
(5)如何证明元素⑦与⑧的非金属性强弱,写出可以验证该结论的一个离子反应方程式S2-+Cl2=S↓+2Cl-.
(6)在这些元素中VIIA氢化物的稳定性由强到弱HF>HCl>HBr(用化学式作答)
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
 ①的气态氢化物的电子式
①的气态氢化物的电子式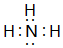 .
.(2)写出⑪元素基态原子的价电子排布式4s2.
(3)在这些元素的最高价氧化物对应水化物中,有一种呈两性的用来治疗胃酸过多反应的离子方程式:Al(OH)3+3H+=Al3++3H2O.
(4)在这些元素中,某元素的最高价氧化物对应的水化物可以和其气态氢化物反应,写出该反应化学方程式NH3+HNO3=NH4NO3或 2H2S+H2SO4(浓)=3H2O+2S+SO2.
(5)如何证明元素⑦与⑧的非金属性强弱,写出可以验证该结论的一个离子反应方程式S2-+Cl2=S↓+2Cl-.
(6)在这些元素中VIIA氢化物的稳定性由强到弱HF>HCl>HBr(用化学式作答)
 苯是一种石油化工基本原料,也是最简单的芳烃.苯分子中的一个氢原子分别被甲基、羟基、氨基取代生成的化合物是甲苯、苯酚和苯胺.
苯是一种石油化工基本原料,也是最简单的芳烃.苯分子中的一个氢原子分别被甲基、羟基、氨基取代生成的化合物是甲苯、苯酚和苯胺.


