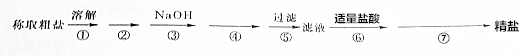
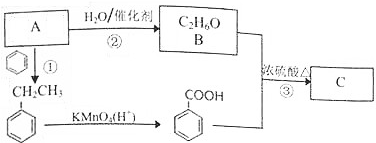
题目内容
5.NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 68g KHSO4晶体中含有SO42-的数目为0.5NA | |
| B. | 把含0.1molFeCl3的浓溶液加入沸水中形成0.1NA个氢氧化铁胶粒 | |
| C. | 标况下2.24L丙烯分子中含有的共用电子对数目为0.9NA | |
| D. | 把5mL 11.2mol/L的浓盐酸与足量的MnO2固体混合,加热充分反应后,把产生的气体完全溶于水时,转移电子的数目为0.014NA |
分析 A、硫酸氢钾晶体由钾离子和硫酸氢根构成;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
C、求出丙烯的物质的量,然后根据丙烯中含9对共用电子对来分析;
D、二氧化锰只能和浓盐酸反应,和稀盐酸不反应.
解答 解:A、硫酸氢钾晶体由钾离子和硫酸氢根构成,故硫酸氢钾晶体中无硫酸根,故A错误;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故形成的胶粒的个数小于0.1NA个,故B错误;
C、标况下2.24L丙烯的物质的量为0.1mol,而丙烯中含9对共用电子对,故0.1mol丙烯中含0.9NA对共用电子对,故C正确;
D、二氧化锰只能和浓盐酸反应,和稀盐酸不反应,故浓盐酸不能反应完全,则生成的氯气的物质的量无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
16.将过量SO2通入下列溶液中,能出现白色浑浊的是( )
①Ca(OH)2;
②BaCl2;
③NaAlO2;
④Na2SiO3;
⑤Ba(NO3)2;
⑥苯酚钠;
⑦Na2CO3.
①Ca(OH)2;
②BaCl2;
③NaAlO2;
④Na2SiO3;
⑤Ba(NO3)2;
⑥苯酚钠;
⑦Na2CO3.
| A. | ①②④⑦ | B. | ②③⑥⑦ | C. | ④⑤⑥⑦ | D. | ④⑤⑥ |
13.下列实验的操作和所用的试剂都正确的是( )
| A. | 要检验己烯中是否混有少量甲苯,应先加足量溴水,然后再加入酸性高锰酸钾溶液 | |
| B. | 配制浓硫酸和浓硝酸的混酸时,将浓硝酸沿壁缓缓倒入到浓硫酸中 | |
| C. | 制硝基苯时,将盛有混合液的试管直接在酒精灯火焰上加热 | |
| D. | 除去乙酸乙酯中少量的乙酸,可以加氢氧化钠溶液后分液 |
17.下列离子方程式书写正确的是( )
| A. | 铝粉投入到冷浓硝酸中:2Al+6H+=2Al3++3H2↑ | |
| B. | 铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 用小苏打治疗胃酸过多:H++HCO3-=H2O+CO2↑ | |
| D. | Ba(OH)2与稀H2SO4反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
20.下列物质燃烧时,不会造成大气污染的是( )
| A. | 石油 | B. | 农作物秸秆 | C. | 煤 | D. | 氢气 |
 +CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$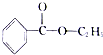 +H2O.
+H2O.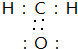


 .
. .
. .
. 的合成路线,合成路线流程图示例如下:CH2-CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线,合成路线流程图示例如下:CH2-CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.