题目内容
6.100mL 6mol/L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )| A. | 碳酸钠(固体) | B. | 水 | C. | 稀盐酸 | D. | 硫酸铵(固体) |
分析 过量的锌粉反应,硫酸完全反应,为了减缓反应速率但又不影响生成氢气的总量,可减小氢离子浓度但不改变其物质的量,以此来解答.
解答 解:A.碳酸钠能与稀硫酸反应生成CO2、水和硫酸钠,减少氢离子的物质的量,反应速率降低,但生成的氢气也减少,故A错误;
B.加水稀释,氢离子的浓度降低,物质的量不变,反应速率降低,生成的氢气不变,故B正确;
C.加入盐酸,与过量锌粉反应,生成氢气的总量会增加,故C错误;
D.铵根离子水解呈酸性,生成氢气的总量增大,故D错误.
故选B.
点评 本题考查影响化学反应速率的因素,为高频考点,侧重于学生的分析能力的考查,明确浓度对反应速率的影响即可解答,选项D为学生解答中的难点,注意盐类水解的特点,题目难度不大.

练习册系列答案
相关题目
16.将过量SO2通入下列溶液中,能出现白色浑浊的是( )
①Ca(OH)2;
②BaCl2;
③NaAlO2;
④Na2SiO3;
⑤Ba(NO3)2;
⑥苯酚钠;
⑦Na2CO3.
①Ca(OH)2;
②BaCl2;
③NaAlO2;
④Na2SiO3;
⑤Ba(NO3)2;
⑥苯酚钠;
⑦Na2CO3.
| A. | ①②④⑦ | B. | ②③⑥⑦ | C. | ④⑤⑥⑦ | D. | ④⑤⑥ |
17.下列离子方程式书写正确的是( )
| A. | 铝粉投入到冷浓硝酸中:2Al+6H+=2Al3++3H2↑ | |
| B. | 铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 用小苏打治疗胃酸过多:H++HCO3-=H2O+CO2↑ | |
| D. | Ba(OH)2与稀H2SO4反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
11.同温、同压下,盛有氧气的A容器与盛有氨气的B容器中,所含原子个数相等,则A与B的体积比是( )
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 2:3 |
3.甲、乙、丙、丁四种有机物的结构如表:
球棍模型中“棍”代表单键或双键或三键.
下列叙述不正确的是( )
| 甲的球棍模型 | 乙的结构式 | 丙的球棍模型 | 丁的比例模型 |
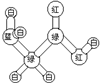 |  | 丙的分子式为C13H10O3 | 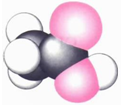 |
下列叙述不正确的是( )
| A. | 甲可代表氨基酸 | B. | 乙的二氯代物有3种 | ||
| C. | 丙的结构简式为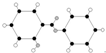 | D. | 丁可代表乙酸 |
20.下列物质燃烧时,不会造成大气污染的是( )
| A. | 石油 | B. | 农作物秸秆 | C. | 煤 | D. | 氢气 |
1.今年地球日主题为:“珍惜地球资源 转变发展方式 倡导低碳生活”.旨在借助地球日活动平台提高公众对国土资源国情的认识,普及有关科学技术知识,引导全社会积极参与节约集约利用资源、减少碳排放、促进经济发展.下列做法不符合“低碳经济”要求的是( )
| A. | 大力发展以煤炭为原料的火力发电,促进经济发展 | |
| B. | 在生产和生活中提倡使用节能技术和节能用具 | |
| C. | 开发新能源,代替传统能源 | |
| D. | 提倡乘坐公交车、骑自行车或步行的方式出行 |


 .
. .
. .
. 的合成路线,合成路线流程图示例如下:CH2-CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线,合成路线流程图示例如下:CH2-CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.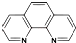 ),它能与Fe2+形成红色配合物(如图甲),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图甲),该配离子中Fe2+与氮原子形成配位键共有6个.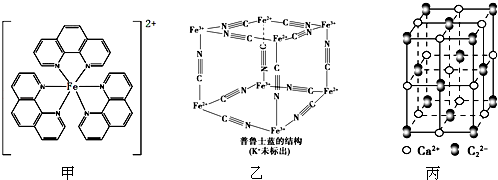
 ,其中σ键与π键数目之比为1:2.
,其中σ键与π键数目之比为1:2.