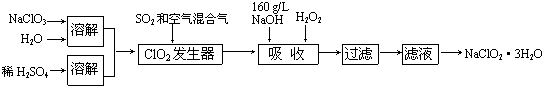
题目内容
10.锂-磷酸氧铜电池正极的活性物质是 Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3•H2O═Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O.请回答下列问题.(1)上述方程式中涉及到的 N、O 元素电负性由小到大的顺序是N<O.
(2)基态 S 的价电子排布式为3s23p4.与 Cu 同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
(3)PO43-的空间构型是正四面体,其中 P 原子的杂化方式为sp3.
(4)在硫酸铜溶液中加入过量的 KSCN 溶液,生成配合物[Cu(CN)4]2-,则 1molCN-中含有的 π 键的数目为2NA.
(5)铜晶体为面心立方最密集堆积,铜的原子半径为 127.8pm,列式计算晶体铜的密度9.0g/cm3.
(6)如表列出了含氧酸酸性强弱与非羟基氧原子数的关系.
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 |  |  |  | 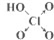 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O.
分析 (1)根据元素周期律判断电负性大小;
(2)根据S最外层有6个电子,写出其价电子排布式;Cu最外层有1个电子,数根据其最外层电子数判断;
(3)根据磷原子价层电子对互斥理论确定其空间构型及磷原子的杂化方式;
(4)在CN-中碳原子与氮原子是以共价三键结合的,含有1个?键,2个π键;
(5)铜晶体为面心立方最密集堆积,据此可计算出晶胞中含有铜原子数,根据公式ρ=$\frac{m}{V}$计算得出密度;
(6)根据表中数据可以看出非羟基氧原子数与酸性强弱的关系,亚磷酸(H3PO3)是中强酸,说明有1个非羟基氧原子,据此写出它的结构式,含氧酸中羟基中的氢能被氢氧化钠中和,据此写化学方程式.
解答 解:(1)根据元素周期律,同周期元素,从左向右,电负性逐渐增大,所以N、O元素电负性由小到大的顺序为N<O,
故答案为:N<O;
(2)S最外层有6个电子,其价电子排布式为3s23p4;Cu最外层有1个电子,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有K、Cr,
故答案为:3s23p4;K、Cr;
(3)PO43-中P原子的价层电子对数=4+$\frac{1}{2}$(5+3-4×2)=4,所以P原子按sp3方式杂化,P原子周围不含孤电子对,所以其空间构型正四面体,
故答案为:正四面体;sp3;
(4)在CN-中碳原子与氮原子是以共价三键结合的,含有1个?键,2个π键,所以1molCN-中含有的π键的数目为2NA,
故答案为:2NA;
(5)铜晶体为面心立方最密堆积,则每个晶胞中含有铜的原子:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Cu原子半径为r=127.8pm=1.278×10-8cm,设晶胞的边长为d,则有 $\sqrt{2}$d=4r,所以d=2 $\sqrt{2}$r,所以晶体铜的密度ρ=$\frac{4×64}{{N}_{A}}$÷d3=$\frac{4×64}{{N}_{A}(2\sqrt{2}×1.278×1{0}^{-8})^{3}}$g/cm3=9.0g/cm3,
故答案为:9.0;
(6)根据表中数据可以看出非羟基氧原子数越多,该含氧酸的酸性越强,亚磷酸(H3PO3)是中强酸,说明有1个非羟基氧原子,据此可写出它的结构式为: ,含氧酸中羟基中的氢能被氢氧化钠中和,所以1molH3PO3可与2molNaOH反应,反应化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O,
,含氧酸中羟基中的氢能被氢氧化钠中和,所以1molH3PO3可与2molNaOH反应,反应化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O,
故答案为:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强; ;H3PO3+2NaOH=Na2HPO3+2H2O.
;H3PO3+2NaOH=Na2HPO3+2H2O.
点评 本题考查了电负性、核外电子排布、杂化方式、分子构型及晶胞的计算等内容,综合性强,难度较大,注意利用均摊法计算晶胞原子数目.

| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)①③⑤三种元素的最高价氧化物对应水化物中,碱性最强的化合物的化学式是NaOH
(3)①②③三种元素的原子半径由大到小的顺序是K>Na>Mg.
(4)⑧⑨两种元素氢化物稳定性强弱的顺序是HCl>HBr,它们都是分子晶体.
(5)①⑧两种元素形成的化合物属于离子化合物(填“共价”或“离子”,下同),⑥⑧两种元素形成的化合物属于共价化合物.
| A. | 甲醛和乙二醛 | |
| B. | 乙醛和丙醛 | |
| C. | 丙醛和苯甲醛 | |
| D. | 只能判断其中有甲醛另一醛无法求得 |
| A. | NaCl、SO3的水溶液均能导电,所以NaCl、SO3均为电解质 | |
| B. | 金属元素的原子只有还原性,其阳离子只有氧化性 | |
| C. | 用激光笔照射FeCl3溶液和Fe(OH)3胶体时,产生的现象不同 | |
| D. | 合金的硬度一般小于它的成分金属,熔点高于它的成分金属 |
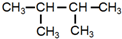
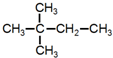
 .
.