题目内容
19.下列说法正确的是( )| A. | NaCl、SO3的水溶液均能导电,所以NaCl、SO3均为电解质 | |
| B. | 金属元素的原子只有还原性,其阳离子只有氧化性 | |
| C. | 用激光笔照射FeCl3溶液和Fe(OH)3胶体时,产生的现象不同 | |
| D. | 合金的硬度一般小于它的成分金属,熔点高于它的成分金属 |
分析 A.水溶液中或熔融状态下导电的化合物为电解质;
B.金属单质在反应中只能失去电子,亚铁离子既有氧化性又有还原性;
C.胶体具有丁达尔效应;
D.合金硬度大于成分金属,合金熔点低于成分金属.
解答 解:A.SO3的水溶液能导电是因为三氧化硫溶于水和水反应生成硫酸是电解质电离出离子溶液导电,三氧化硫自身不能电离属于非电解质,故A错误;
B.金属单质在反应中只能失去电子,但处于中间价态的金属离子既有氧化性又有还原性,如亚铁离子既有氧化性又有还原性,故B错误;
C.胶体具有丁达尔效应、溶液没有丁达尔效应,所以可以用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液,故C正确;
D.合金的硬度比它的各成分金属大,合金熔点低于成分金属,故D错误;
故选C.
点评 本题考查了电解质概念、胶体的性质、氧化还原反应、合金的性质等,熟悉合金的硬度大,熔点低,耐腐蚀的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
10.锂-磷酸氧铜电池正极的活性物质是 Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3•H2O═Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O.请回答下列问题.
(1)上述方程式中涉及到的 N、O 元素电负性由小到大的顺序是N<O.
(2)基态 S 的价电子排布式为3s23p4.与 Cu 同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
(3)PO43-的空间构型是正四面体,其中 P 原子的杂化方式为sp3.
(4)在硫酸铜溶液中加入过量的 KSCN 溶液,生成配合物[Cu(CN)4]2-,则 1molCN-中含有的 π 键的数目为2NA.
(5)铜晶体为面心立方最密集堆积,铜的原子半径为 127.8pm,列式计算晶体铜的密度9.0g/cm3.
(6)如表列出了含氧酸酸性强弱与非羟基氧原子数的关系.
由此可得出的判断含氧酸强弱的一条经验规律是含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强.亚磷酸 (H3PO3 ) 也是中强酸,它的结构式为 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O.
(1)上述方程式中涉及到的 N、O 元素电负性由小到大的顺序是N<O.
(2)基态 S 的价电子排布式为3s23p4.与 Cu 同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
(3)PO43-的空间构型是正四面体,其中 P 原子的杂化方式为sp3.
(4)在硫酸铜溶液中加入过量的 KSCN 溶液,生成配合物[Cu(CN)4]2-,则 1molCN-中含有的 π 键的数目为2NA.
(5)铜晶体为面心立方最密集堆积,铜的原子半径为 127.8pm,列式计算晶体铜的密度9.0g/cm3.
(6)如表列出了含氧酸酸性强弱与非羟基氧原子数的关系.
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 |  |  |  | 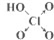 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O.
7.下列叙述正确的是( )
| A. | 有水参加的有机化学反应都可以叫做水解反应 | |
| B. | 丙烯、氯乙烯、苯分子内所有原子均在同一平面 | |
| C. | 棉花和木材在主要成分是纤维素,羊毛和蚕丝的主要成分是蛋白质 | |
| D. | 蔗糖是分布最广的二糖,一分子蔗糖能水解为两分子葡萄糖 |
14.下列化学用语表达正确的是( )
| A. | Cl-离子的结构示意图: | |
| B. | 水分子的电子式: | |
| C. | 乙醇的结构简式:C2H6O | |
| D. | 硫酸钠的电离方程式:Na2SO4=2Na++SO42- |
11.在①甲烷、②乙烯、③苯、④甲苯四种有机物化合物,分子内所有原子均在同一平面的是( )
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
8.下列气体不能与O2共存的是( )
| A. | Cl2 | B. | NO | C. | SO2 |
9.下列有关物质用途的说法中,不正确的是( )
| A. | 氢氟酸可用来刻蚀玻璃 | B. | 过氧化钠常用作供氧剂 | ||
| C. | 晶体硅可用于制作光导纤维 | D. | 漂白粉可用作游泳池的消毒剂 |
 醋酸亚铬水合物{[Cr(CH3COO2)]2•2H2O,深红色晶体}易被氧气氧化,是一种氧气吸收剂,通常以二聚体分子的形式存在,不溶于水,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示.
醋酸亚铬水合物{[Cr(CH3COO2)]2•2H2O,深红色晶体}易被氧气氧化,是一种氧气吸收剂,通常以二聚体分子的形式存在,不溶于水,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示.