题目内容
1.某温度下,2L密闭容器中,充 入0.02mol H2,0.02mol I2,H2(g)+I2(g)?2HI(g)△H<0平衡时H2浓度为0.004mol/L,则:(1)该温度下的平衡常数为多少?
(2)该温度下若充入0.04molH2,0.04molI2,则平衡时H2浓度为多少?H2转化率为多少?
分析 (1)开始时,c(H2)=c(I2)=$\frac{0.02mol}{2L}$=0.01mol/L,平衡时H2浓度为0.004mol/L,则
H2(g)+I2(g)?2HI(g)
开始 0.01 0.01 0
转化 0.006 0.006 0.012
平衡 0.004 0.004 0.012
结合K为生成物浓度幂之积与反应物浓度幂之积的比计算;
(2)相同温度下K相同,开始时,c(H2)=c(I2)=$\frac{0.04mol}{2L}$=0.02mol/L,设转化的氢气为x,则
H2(g)+I2(g)?2HI(g)
开始 0.02 0.02 0
转化 x x 2x
平衡 0.02-x 0.02-x 2x
结合K计算.
解答 解:(1)开始时,c(H2)=c(I2)=$\frac{0.02mol}{2L}$=0.01mol/L,平衡时H2浓度为0.004mol/L,则
H2(g)+I2(g)?2HI(g)
开始 0.01 0.01 0
转化 0.006 0.006 0.012
平衡 0.004 0.004 0.012
该温度下的平衡常数为K=$\frac{(0.012)^{2}}{0.004×0.004}$=9,
答:该温度下的平衡常数为9;
(2)相同温度下K相同,开始时,c(H2)=c(I2)=$\frac{0.04mol}{2L}$=0.02mol/L,设转化的氢气为x,则
H2(g)+I2(g)?2HI(g)
开始 0.02 0.02 0
转化 x x 2x
平衡 0.02-x 0.02-x 2x
则$\frac{(2x)^{2}}{(0.02-x)(0.02-x)}$=9,
解得x=0.012,
则平衡时H2浓度为0.02mol/L-0.012mol/L=0.008mol/L,
H2转化率为$\frac{0.012}{0.02}$×100%=60%,
答:平衡时H2浓度为0.008mol/L,H2转化率为60%.
点评 本题考查化学平衡常数及计算,为高频考点,把握化学平衡三段法、平衡浓度与K的关系为解答的关键,侧重分析与计算能力的考查,注意相同温度下K相同,题目难度不大.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案| A. | 14 | B. | 15 | C. | 16 | D. | 17 |
| A. | 元素X形成的单质一定是原子晶体 | |
| B. | X与Z形成的化合物具有熔点高、硬度大的特点 | |
| C. | Y与氧元素形成的化合物Y2O2中阴、阳离子的个数比为1:1 | |
| D. | W分别与Y、Z形成的化合物中含有的化学键类型相同 |
| A. | H2SO4的摩尔质量是98 | |
| B. | 等物质的量的O2和O3中所含的氧原子数相同 | |
| C. | 等质量的CO与CO2中所含碳原子数之比为11:7 | |
| D. | 将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L |
(1)上述方程式中涉及到的 N、O 元素电负性由小到大的顺序是N<O.
(2)基态 S 的价电子排布式为3s23p4.与 Cu 同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
(3)PO43-的空间构型是正四面体,其中 P 原子的杂化方式为sp3.
(4)在硫酸铜溶液中加入过量的 KSCN 溶液,生成配合物[Cu(CN)4]2-,则 1molCN-中含有的 π 键的数目为2NA.
(5)铜晶体为面心立方最密集堆积,铜的原子半径为 127.8pm,列式计算晶体铜的密度9.0g/cm3.
(6)如表列出了含氧酸酸性强弱与非羟基氧原子数的关系.
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 |  |  |  | 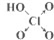 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O. | A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
 醋酸亚铬水合物{[Cr(CH3COO2)]2•2H2O,深红色晶体}易被氧气氧化,是一种氧气吸收剂,通常以二聚体分子的形式存在,不溶于水,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示.
醋酸亚铬水合物{[Cr(CH3COO2)]2•2H2O,深红色晶体}易被氧气氧化,是一种氧气吸收剂,通常以二聚体分子的形式存在,不溶于水,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示.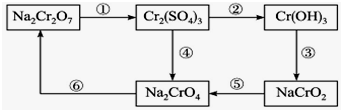 铬是水体的主要的污染物之一,可以导致水生生物死亡.化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该有害物质.例如处理铬的实验循环示意图如图:
铬是水体的主要的污染物之一,可以导致水生生物死亡.化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该有害物质.例如处理铬的实验循环示意图如图: