题目内容
15.下列物质进行一氯取代反应后,只能生成4种沸点不同的有机产物的是( )| A. | 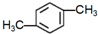 | B. | 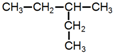 | C. | 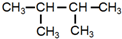 | D. | 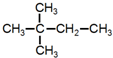 |
分析 有机物分子中含有4种等效氢原子,则其一氯代物就有4种,进行一氯取代反应后,就能够生成4种沸点不同的有机产物,以此解答该题.
解答 解:A. 中含有两种等效氢原子,其一氯代物只有2种,故A错误;
中含有两种等效氢原子,其一氯代物只有2种,故A错误;
B. ,该有机物分子中含有4种等效H原子,其一氯代物有4种,进行一氯取代反应后,只能生成4种沸点不同的有机产物,故B正确;
,该有机物分子中含有4种等效H原子,其一氯代物有4种,进行一氯取代反应后,只能生成4种沸点不同的有机产物,故B正确;
C.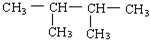 中只有2种等效氢原子,其一氯代物只有2种,故C错误;
中只有2种等效氢原子,其一氯代物只有2种,故C错误;
D.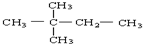 中含有3种等效氢原子,其一氯代物有3种,故D错误;
中含有3种等效氢原子,其一氯代物有3种,故D错误;
故选B.
点评 本题考查有机物的结构和性质,侧重考查了同分异构体的判断,题目难度不大,注意掌握同分异构体的概念及书写方法,明确互同分异构体的有机物分子之间沸点不同.

练习册系列答案
相关题目
5.下列有关Na2CO3和NaHCO3的说法中,正确的是( )
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 相同温度下在水中的溶解度:Na2CO3<NaHCO3 | |
| C. | 取1 mol•L-1的两种溶液,分别滴加澄清石灰水,有沉淀生成的是Na2CO3溶液 | |
| D. | 取等质量的两种固体分别与等浓度等体积的盐酸反应,生成气泡较快的是NaHCO3溶液 |
6.某元素原子的原子核外有三个电子层,K层电子数为a,L层电子数为b,M层电子数为b-a,该原子核内的质子数是( )
| A. | 14 | B. | 15 | C. | 16 | D. | 17 |
3.下列表达式中不正确的是( )
| A. | S2-的电子排布式为1s22s22p63s23p6 | |
| B. | 26号元素的电子排布式为[Ar]3d64s2 | |
| C. | 基态C原子的轨道表示式为  | |
| D. | 基态N原子的轨道表示式为  |
10.下列实验或叙述不符合绿色化学理念的是( )
| A. | 研制乙醇汽油代替汽油作汽车燃料 | |
| B. | 利用乙烯和氯化氢在催化剂存在的条件下生成氯乙烷 | |
| C. | 在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水 | |
| D. | 用铜和浓H2SO4反应制取Cu SO4 |
7.短周期元素X、Y、Z、W 的原子序数依次增大,X原子的最外层电子数是内层电子数的2倍,X与Z同主族,Y和氢元素同主族,W原子的最外层电子数比次外层电子数少1.下列说法正确的是( )
| A. | 元素X形成的单质一定是原子晶体 | |
| B. | X与Z形成的化合物具有熔点高、硬度大的特点 | |
| C. | Y与氧元素形成的化合物Y2O2中阴、阳离子的个数比为1:1 | |
| D. | W分别与Y、Z形成的化合物中含有的化学键类型相同 |
10.锂-磷酸氧铜电池正极的活性物质是 Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3•H2O═Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O.请回答下列问题.
(1)上述方程式中涉及到的 N、O 元素电负性由小到大的顺序是N<O.
(2)基态 S 的价电子排布式为3s23p4.与 Cu 同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
(3)PO43-的空间构型是正四面体,其中 P 原子的杂化方式为sp3.
(4)在硫酸铜溶液中加入过量的 KSCN 溶液,生成配合物[Cu(CN)4]2-,则 1molCN-中含有的 π 键的数目为2NA.
(5)铜晶体为面心立方最密集堆积,铜的原子半径为 127.8pm,列式计算晶体铜的密度9.0g/cm3.
(6)如表列出了含氧酸酸性强弱与非羟基氧原子数的关系.
由此可得出的判断含氧酸强弱的一条经验规律是含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强.亚磷酸 (H3PO3 ) 也是中强酸,它的结构式为 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O.
(1)上述方程式中涉及到的 N、O 元素电负性由小到大的顺序是N<O.
(2)基态 S 的价电子排布式为3s23p4.与 Cu 同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
(3)PO43-的空间构型是正四面体,其中 P 原子的杂化方式为sp3.
(4)在硫酸铜溶液中加入过量的 KSCN 溶液,生成配合物[Cu(CN)4]2-,则 1molCN-中含有的 π 键的数目为2NA.
(5)铜晶体为面心立方最密集堆积,铜的原子半径为 127.8pm,列式计算晶体铜的密度9.0g/cm3.
(6)如表列出了含氧酸酸性强弱与非羟基氧原子数的关系.
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 |  |  |  | 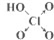 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O. 
 (1,4-二甲苯)、
(1,4-二甲苯)、 (1,3,5-三甲苯).
(1,3,5-三甲苯). 醋酸亚铬水合物{[Cr(CH3COO2)]2•2H2O,深红色晶体}易被氧气氧化,是一种氧气吸收剂,通常以二聚体分子的形式存在,不溶于水,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示.
醋酸亚铬水合物{[Cr(CH3COO2)]2•2H2O,深红色晶体}易被氧气氧化,是一种氧气吸收剂,通常以二聚体分子的形式存在,不溶于水,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示.