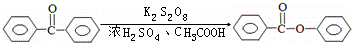题目内容
5.下表为元素周期表中的一部分,表中列出了11种元素在周期表中的位置,按要求完成下列各小题.| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)①③⑤三种元素的最高价氧化物对应水化物中,碱性最强的化合物的化学式是NaOH
(3)①②③三种元素的原子半径由大到小的顺序是K>Na>Mg.
(4)⑧⑨两种元素氢化物稳定性强弱的顺序是HCl>HBr,它们都是分子晶体.
(5)①⑧两种元素形成的化合物属于离子化合物(填“共价”或“离子”,下同),⑥⑧两种元素形成的化合物属于共价化合物.
分析 由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar,⑪为F,
(1)稀有气体的性质最稳定,F的非金属性最强,K的金属性最强;
(2)金属性越强,对应碱的碱性越强;
(3)电子层越多,原子半径越大,同周期从左向右原子半径减小;
(4)非金属性越强,对应氢化物越稳定;
(5)①⑧两种元素形成的化合物为NaCl,⑥⑧两种元素形成的化合物为四氯化碳.
解答 解:由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar,⑪为F,
(1)稀有气体的性质最稳定,F的非金属性最强,K的金属性最强,K与水反应生成氢氧化钾与氢气,反应离子方程式为:2K+2H2O=2K++2OH-+H2↑,
故答案为:Ar;F;2K+2H2O=2K++2OH-+H2↑;
(2)金属性越强,对应碱的碱性越强,则①③⑤三种元素的最高价氧化物对应水化物中,碱性最强的化合物的化学式是NaOH,
故答案为:NaOH;
(3)电子层越多,原子半径越大,同周期从左向右原子半径减小,则①②③三种元素的原子半径由大到小的顺序是K>Na>Mg,
故答案为:K;Na;Mg;
(4)非金属性越强,对应氢化物越稳定,则⑧⑨两种元素氢化物稳定性强弱的顺序是HCl>HBr,均由分子构成,均为分子晶体,
故答案为:HCl;HBr;分子;
(5)①⑧两种元素形成的化合物为NaCl,含离子键,为离子化合物;⑥⑧两种元素形成的化合物为四氯化碳,含共价键,为共价化合物,故答案为:离子;共价.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素周期律、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

| A. | 研制乙醇汽油代替汽油作汽车燃料 | |
| B. | 利用乙烯和氯化氢在催化剂存在的条件下生成氯乙烷 | |
| C. | 在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水 | |
| D. | 用铜和浓H2SO4反应制取Cu SO4 |
| A. | H2SO4的摩尔质量是98 | |
| B. | 等物质的量的O2和O3中所含的氧原子数相同 | |
| C. | 等质量的CO与CO2中所含碳原子数之比为11:7 | |
| D. | 将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L |
| A. | 乙烷和氯气取代 | B. | 乙烯与氢气加成,再用氯气取代 | ||
| C. | 乙烯和氯化氢加成 | D. | 乙炔和氯化氢加成 |
(1)上述方程式中涉及到的 N、O 元素电负性由小到大的顺序是N<O.
(2)基态 S 的价电子排布式为3s23p4.与 Cu 同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
(3)PO43-的空间构型是正四面体,其中 P 原子的杂化方式为sp3.
(4)在硫酸铜溶液中加入过量的 KSCN 溶液,生成配合物[Cu(CN)4]2-,则 1molCN-中含有的 π 键的数目为2NA.
(5)铜晶体为面心立方最密集堆积,铜的原子半径为 127.8pm,列式计算晶体铜的密度9.0g/cm3.
(6)如表列出了含氧酸酸性强弱与非羟基氧原子数的关系.
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 |  |  |  | 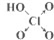 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O. | A. | Cl-离子的结构示意图: | |
| B. | 水分子的电子式: | |
| C. | 乙醇的结构简式:C2H6O | |
| D. | 硫酸钠的电离方程式:Na2SO4=2Na++SO42- |
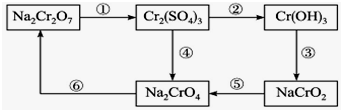 铬是水体的主要的污染物之一,可以导致水生生物死亡.化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该有害物质.例如处理铬的实验循环示意图如图:
铬是水体的主要的污染物之一,可以导致水生生物死亡.化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该有害物质.例如处理铬的实验循环示意图如图: 苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.
苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.