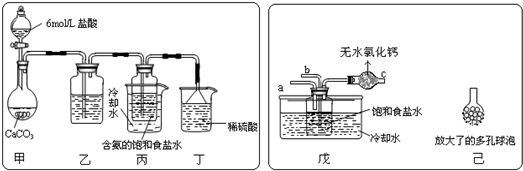
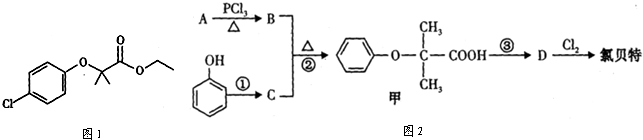
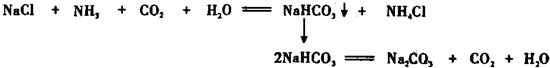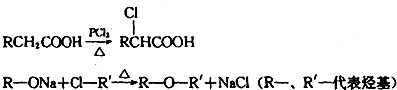题目内容
已知难溶电解质溶解平衡时M(OH)2(s)?M2+(aq)+2OH-(aq),溶液的PH=a,则其Ksp= .
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:依据pH计算溶液中氢氧根的浓度,依据溶解方程式确定M离子的浓度,然后代入溶度积常数计算公式计算即可.
解答:
解:pH=a的溶液,c(H+)=1×10-a,故c(OH-)=
=
=1×10a-14,依据M(OH)2(s)?M2+(aq)+2OH-(aq)得c(M2+)=
c(OH-)=
,故Ksp=c(M2+)×c2(OH-)=
×1×10a-14×(1×10a-14)2=
,故答案为:
.
| Kw |
| c(H+) |
| 1×10-14 |
| 1×10-a |
| 1 |
| 2 |
| 1×10a-14 |
| 2 |
| 1 |
| 2 |
| 103a-42 |
| 2 |
| 103a-42 |
| 2 |
点评:本题主要考查的是溶度积常数的计算,利用水的离子积计算氢氧根的浓度是解决本题的关键,属于基础题.

练习册系列答案
相关题目
 用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )| 气体 | a | b | c | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | Cu | 酸性KMnO4溶液 |
| C | CO2 | 稀盐酸 | CaCO3 | 浓硫酸 |
| D | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| A、A | B、B | C、C | D、D |
已知:2A(s)+C2(g)=2AC(s)△H=-500kJ?mol-1;2B(l)+C2(g)=2BC(s)△H=-200kJ?mol-1
则反应A(s)+BC(s)=AC(s)+B(l)的△H为( )
则反应A(s)+BC(s)=AC(s)+B(l)的△H为( )
| A、+300 kJ?mol_1 |
| B、+150 kJ?mol_1 |
| C、-300 kJ?mol_1 |
| D、-150 kJ?mol_1 |