题目内容
近年来,碳和碳的化合物在生产生活实际中应用广泛.甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活.已知 ①2CH4(g)+3O2(g)=2CO (g)+4H2O(l)△H1=-1214.6KJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566kJ/mol
则反应CH4(g)+2O2(g)=CO2(g)+2H2O (l) 的△H= .
②2CO (g)+O2(g)=2CO2(g)△H2=-566kJ/mol
则反应CH4(g)+2O2(g)=CO2(g)+2H2O (l) 的△H=
考点:用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214.6kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ?mol-1
依据盖斯定律计算,①+②得到,2CH4(g)+4O2(g)=2CO2(g)+4H2O(l)△H.
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ?mol-1
依据盖斯定律计算,①+②得到,2CH4(g)+4O2(g)=2CO2(g)+4H2O(l)△H.
解答:
解:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214.6kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ?mol-1
依据盖斯定律计算,①+②得到,2CH4(g)+4O2(g)=2CO2(g)+4H2O(l)△H=-1780.6KJ/mol;
热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ?mol-1;
故答案为:-890.3 kJ?mol-1.
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ?mol-1
依据盖斯定律计算,①+②得到,2CH4(g)+4O2(g)=2CO2(g)+4H2O(l)△H=-1780.6KJ/mol;
热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ?mol-1;
故答案为:-890.3 kJ?mol-1.
点评:本题考查了盖斯定律在反应热计算中的应用,题目难度中等,注意掌握盖斯定律的概念、含义及在反应热计算的中应方法,试题培养了学生灵活应用所学知识.

练习册系列答案
相关题目
实验:①0.1mol?L-1AgNO3溶液和0.1mol?L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1mol?L-1KI溶液,出现浑浊;③向沉淀c中滴加0.1mol?L-1KI溶液,沉淀变为黄色.下列分析错误的是( )
| A、浊液a中存在着AgCl沉淀溶解平衡 |
| B、滤液b中不含有Ag+ |
| C、③中颜色变化说明AgCl转化为AgI |
| D、实验可以证明AgI比AgCl更难溶 |
下列化肥中,属于钾肥的是( )
| A、K2SO4 |
| B、(NH4)2SO4 |
| C、NH4NO3 |
| D、Ca(H2PO4)2 |

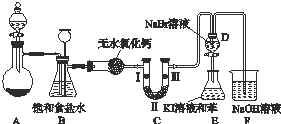 高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用.如图K103是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用.如图K103是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).