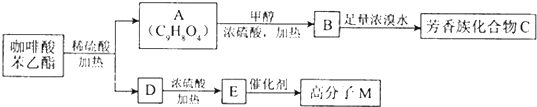
题目内容
 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4回答下列问题:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4回答下列问题:(1)PbO2和PbO的混合物中,Pb和O的物质的量之比为8:11,则混合物中,PbO2和PbO的物质的量之比为
(2)用足量的CO还原13.7g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式可表示为
(3)PbO2具有强氧化性,能氧化浓HCl生成Cl2,+4价的Pb 被还原成+2价的Pb,+2价的Pb不具备该性质,据下列信息回答问题:①将a mol PbO2加热分解一段时间,生成PbO和O2;②将①所得固体加入足量的浓盐酸,收集产生的Cl2;已知在①加热一段时间后剩余的固体中,+2价的Pb占铅元素质量分数为x;则反应过程中生成的氧气和氯气物质的量总和是多少?
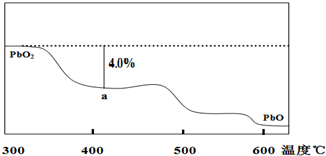
(4)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0% (即样品起始质量-a点固体质量)/样品起始质量×100%的残留固体.若a点固体组成表示为PbOx或mPbO2?nPbO,列式计算x值和m:n值.
考点:化学方程式的有关计算,物质的量的相关计算
专题:
分析:(1)设混合物中PbO2和PbO的物质的量分别为xmol和ymol,然后根据铅和氧的物质的量之比求解;
(2)沉淀干燥后质量8.0g为碳酸钙质量,据此求出二氧化碳的物质的量,根据二氧化碳的物质的量计算出铅氧化物中氧原子的物质的量及氧元素的质量,再计算出铅元素的质量即铅原子的物质的量,据此书写化学式;
(3)根据氧化还原反应的本质电子得失守恒求出n(O2)、n(Cl2),即得生成的氧气和氯气物质的量总和x的函数关系;
(4)若a点固体组成表示为PbOx,根据PbO2
PbOx+
O2↑列方程计算x的值;若组成表示为mPbO2?nPbO,则O原子与Pb原子的比值为x,据此计算解答.
(2)沉淀干燥后质量8.0g为碳酸钙质量,据此求出二氧化碳的物质的量,根据二氧化碳的物质的量计算出铅氧化物中氧原子的物质的量及氧元素的质量,再计算出铅元素的质量即铅原子的物质的量,据此书写化学式;
(3)根据氧化还原反应的本质电子得失守恒求出n(O2)、n(Cl2),即得生成的氧气和氯气物质的量总和x的函数关系;
(4)若a点固体组成表示为PbOx,根据PbO2
| ||
| 2-x |
| 2 |
解答:
解:(1)设混合物中PbO2和PbO的物质的量分别为xmol和ymol,则(x+y):(2x+y)=8:11,解之得x:y=3:5,故答案为:3:5;
(2)沉淀干燥后质量8.0g为碳酸钙质量,
所以碳酸钙的物质的量为
=0.08mol.
铅氧化物中的氧原子被CO夺取生成CO2,
根据碳元素、氧元素守恒可知CO~~~O~~~CO2~~~CaCO3,
1 1 1
0.08mol 0.08mol 0.08mol
所以铅氧化物中的氧原子的物质的量为0.08mol,氧元素的质量为0.08mol×16g/mol=1.28g;
所以铅氧化物中的铅元素的质量为13.7g-1.28g=12.42g,铅原子的物质的量为
=0.06mol.
所以铅氧化物中铅原子与氧原子的物质的量之比为0.06mol:0.08mol=3:4.
所以铅氧化物的化学式为Pb3O4,
故答案为:Pb3O4;
(3)根据题意:amol PbO2分解所得混合物中n(Pb2+)=ax mol、n(Pb4+)=(1-x)a mol.在反应过程中amol PbO2中+4价的Pb具有强氧化性作氧化剂,
+4价的Pb最终全部降低为+2价,根据得失电子守恒:先加热分解生成O2,得n(O2)=
a=
amol;
后再与足量的浓盐酸反应生成Cl2,得n(Cl2)=a×
=(1-x)a mol,
所以n(O2)+n(Cl2)=
mol+(1-x)a mol=(1-
)amol,
答:反应过程中生成的氧气和氯气物质的量总和是(1-
)amol;
(4)若a点固体组成表示为PbOx,根据PbO2
PbOx+
O2↑有:
×32=239×4.0%,解得x=1.4,
若组成表示为mPbO2?nPbO,则O原子与Pb原子的比值为x,则
=1.4,整理得m:n=2:3,
答:x=1.4;m:n=2:3.
(2)沉淀干燥后质量8.0g为碳酸钙质量,
所以碳酸钙的物质的量为
| 8.0g |
| 100g/mol |
铅氧化物中的氧原子被CO夺取生成CO2,
根据碳元素、氧元素守恒可知CO~~~O~~~CO2~~~CaCO3,
1 1 1
0.08mol 0.08mol 0.08mol
所以铅氧化物中的氧原子的物质的量为0.08mol,氧元素的质量为0.08mol×16g/mol=1.28g;
所以铅氧化物中的铅元素的质量为13.7g-1.28g=12.42g,铅原子的物质的量为
| 12.42g |
| 207g/mol |
所以铅氧化物中铅原子与氧原子的物质的量之比为0.06mol:0.08mol=3:4.
所以铅氧化物的化学式为Pb3O4,
故答案为:Pb3O4;
(3)根据题意:amol PbO2分解所得混合物中n(Pb2+)=ax mol、n(Pb4+)=(1-x)a mol.在反应过程中amol PbO2中+4价的Pb具有强氧化性作氧化剂,
+4价的Pb最终全部降低为+2价,根据得失电子守恒:先加热分解生成O2,得n(O2)=
| 2x |
| 4 |
| x |
| 2 |
后再与足量的浓盐酸反应生成Cl2,得n(Cl2)=a×
| (1-x)×2 |
| 2 |
所以n(O2)+n(Cl2)=
| x |
| 2 |
| x |
| 2 |
答:反应过程中生成的氧气和氯气物质的量总和是(1-
| x |
| 2 |
(4)若a点固体组成表示为PbOx,根据PbO2
| ||
| 2-x |
| 2 |
| 2-x |
| 2 |
若组成表示为mPbO2?nPbO,则O原子与Pb原子的比值为x,则
| 2m+n |
| m+n |
答:x=1.4;m:n=2:3.
点评:本题考查氧化还原反应知识,利用化合价升降法配平,抓住本质电子的得失守恒是解题的关键,同时结合中间值确定反应产物.该题对抽象思维能力要求较高,很容易感觉无从下笔,难度较大.

练习册系列答案
 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
将1.92g 的铜粉与一定量的浓HNO3恰好完全反应,生成标准状况下1120mL 的NO和NO2的混合气体,则此反应中消耗的HNO3的物质的量为( )mol.
| A、0.09 | B、0.11 |
| C、0.06 | D、0.05 |
研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式.以下用于研究有机物的方法中正确的是( )
| A、重结晶法一般适用于被提纯的有机物在溶剂中的溶解度受温度影响较大的混合物的分离 |
| B、对有机物分子红外光谱图的研究有助于确定有机物相对分子质量 |
| C、燃烧法是确定有机物分子官能团的有效方法 |
| D、质谱法通常用于分析确定有机物分子的元素组成 |
用石墨作电极,电解下列物质的溶液,其实质不是电解水的是( )
| A、NaNO3 |
| B、NaOH |
| C、Na2SO4 |
| D、NaCl |
下列离子方程式正确的是( )
| A、铁粉和氯化铁溶液反应 Fe+Fe3+═Fe2+ |
| B、铁和稀盐酸反应 Fe+2H+═Fe2++H2↑ |
| C、氯气通入水中:Cl2+H2O=2H++Cl-+ClO- |
| D、铝和氢氧化钠溶液反应 2Al+2OH-=2AlO2-+3H2↑ |
下列有关浓硫酸的说法正确的是( )
| A、若大量浓硫酸洒在皮肤上应立即用纱布拭去,再用大量水冲洗 |
| B、稀释时要将水沿器壁慢慢倒入浓硫酸中,并用玻璃棒不断搅拌 |
| C、欲除去NH3中的H2O,可让混合气体通过盛有浓硫酸的洗气瓶 |
| D、浓硫酸不分解,不挥发,所以能敞口放置在空气中,质量不会发生变化 |
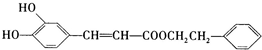 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化: