题目内容
4.称取1.3060g氯化物试样,溶解后于250mL容量瓶中定容.取出25.00mL,以c(AgNO3)=0.1036mol/L的AgNO3溶液滴定,用去20.85mL.计算氯化物试样中氯的质量分数.分析 测定产品中氯化物试样中氯的含量,滴加硝酸银,根据硝酸银的物质的量可确定质量分数;
解答 解:n(AgNO3)=c(AgNO3)V=0.1036mol/L×0.02085L=0.00216mol
Ag++Cl-=AgCl↓
1 35.5
0.00216 m
$\frac{1}{0.00216}=\frac{35.5}{m}$,m=0.07668g
m总(氯化物)=0.07668g×$\frac{250ml}{25ml}$=0.7668g
w(氯化物)=$\frac{0.7668g}{1.3060g}$×100%=58.71%
答:氯化物试样中氯的质量分数为58.71%.
点评 本题考查测定产品中氯化物试样中氯的含量,主要是根据硝酸银的物质的量,确定含氯化合物的两,题目简单.

练习册系列答案
相关题目
12. 我国利用合成气直接制烯烃获重大突破,其原理是( )
我国利用合成气直接制烯烃获重大突破,其原理是( )
反应①:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1
反应②:C(s)+H2O(g)?CO(g)+H2(g)△H2
反应③:CO(g)+2H2(g)?CH3OH(g)△H3=-90.1kJ•mol-1
反应④:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H4,能量变化如图所示
反应⑤:3CH3OH(g)?CH3CH═CH2(g)+3H2O(g)△H5=-31.0kJ•mol-1
下列说法正确的是( )
 我国利用合成气直接制烯烃获重大突破,其原理是( )
我国利用合成气直接制烯烃获重大突破,其原理是( )反应①:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1
反应②:C(s)+H2O(g)?CO(g)+H2(g)△H2
反应③:CO(g)+2H2(g)?CH3OH(g)△H3=-90.1kJ•mol-1
反应④:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H4,能量变化如图所示
反应⑤:3CH3OH(g)?CH3CH═CH2(g)+3H2O(g)△H5=-31.0kJ•mol-1
下列说法正确的是( )
| A. | 反应③使用催化剂,△H3减小 | |
| B. | 反应④中正反应的活化能大于逆反应的活化能 | |
| C. | △H1-△H2<0 | |
| D. | 3CO(g)+6H2(g)?CH3CH═CH2(g)+3H2O(g)△H=-121.1 kJ•mol-1 |
9.下列物质中,可溶于水的是( )
| A. | 胆固醇: | B. | 芬必得: | ||
| C. | 保幼激素JH-I: | D. | 维生素C: |
16.下列有关试剂的保存方法,错误的是( )
| A. | 苯酚晶体隔绝空气密封保存 | |
| B. | 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 | |
| C. | 少量的钠保存在乙醇中 | |
| D. | 新制的氯水通常保存在棕色玻璃试剂瓶中 |
13.下列有关物质的性质或应用的说法正确的是( )
| A. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化 | |
| B. | 用核磁共振氢谱鉴别1-丙醇和2-丙醇 | |
| C. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 | |
| D. | 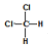 和 和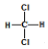 、 、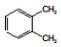 和 和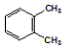 属于同分异构体 属于同分异构体 |
9.水溶液是中学化学的重点研究对象.
(1)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.①浓度为1.0×10-3 mol•L-1的氨水b L;②c(OH-)=1.0×10-3 mol•L-1的氨水c L;③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.
则a、b、c、d之间的关系是b>a=d>c.
(2)已知:Ksp(AgCl)=1.8×10-10,向50mL 0.018mol•L-1的AgNO3溶液中加入相同体积0.020mol•L-1的盐酸,则①c(Ag+)=1.8×10-7mol/L,②此时所得混合溶液的pH=2.
(3)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如表:
①上述盐溶液中的阴离子,结合质子能力最强的是CO32-.
②根据表中数据,浓度均为0.01mol•L-1的下列五种物质的溶液中,分别稀释100倍,pH变化最小的是C(填编号).
A、HCN B、HClO C、HX D、CH3COOH E、H2CO3
③据上表数据,请你判断下列反应不能成立的是BD(填编号).
A.2CH3COOH+Na2CO3═CO2+H2O+2CH3COONa
B.HClO+HCO3-═ClO-+CO2+H2O
C.CH3COOH+NaCN═CH3COONa+HCN
D.CO2+H2O+2NaX═Na2CO3+2HX
(4)将NaHCO3溶液与FeCl3溶液混合,反应的离子方程式是:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑.
(1)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.①浓度为1.0×10-3 mol•L-1的氨水b L;②c(OH-)=1.0×10-3 mol•L-1的氨水c L;③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.
则a、b、c、d之间的关系是b>a=d>c.
(2)已知:Ksp(AgCl)=1.8×10-10,向50mL 0.018mol•L-1的AgNO3溶液中加入相同体积0.020mol•L-1的盐酸,则①c(Ag+)=1.8×10-7mol/L,②此时所得混合溶液的pH=2.
(3)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaX |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②根据表中数据,浓度均为0.01mol•L-1的下列五种物质的溶液中,分别稀释100倍,pH变化最小的是C(填编号).
A、HCN B、HClO C、HX D、CH3COOH E、H2CO3
③据上表数据,请你判断下列反应不能成立的是BD(填编号).
A.2CH3COOH+Na2CO3═CO2+H2O+2CH3COONa
B.HClO+HCO3-═ClO-+CO2+H2O
C.CH3COOH+NaCN═CH3COONa+HCN
D.CO2+H2O+2NaX═Na2CO3+2HX
(4)将NaHCO3溶液与FeCl3溶液混合,反应的离子方程式是:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑.
 ;
;