题目内容
4.向AlCl3溶液中逐滴加入NaOH溶液,现象是先产生白色沉淀,其反应的离子方程式为Al3++3OH-═Al(OH)3↓,后白色沉淀又溶解消失,其反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.分析 先产生白色沉淀为氢氧化铝,后氢氧化铝与NaOH反应生成偏铝酸钠和水,以此来解答.
解答 解:向AlCl3溶液中逐滴加入NaOH溶液,现象是先产生白色沉淀,其反应的离子方程式为Al3++3OH-═Al(OH)3↓,后白色沉淀又溶解消失,其反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al3++3OH-═Al(OH)3↓; Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及氢氧化铝的两性,题目难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
14.常温下,某同学将稀盐酸和氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答:
(1)从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)=1×10-5mol•L-1;从第②组情况表明,c (填“>”“<”或“=”)0.2mol•L-1;从第③组情况分析可知,混合溶液中c(NH4+)>(填“>”“<”或“=”)c(NH3•H2O).
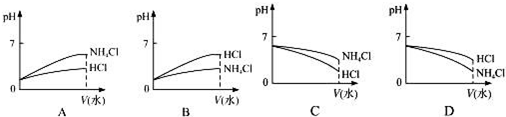
(2)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下面图象正确的是B(填图象符号).
(3)向25mL 0.10mol•L-l的盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是ABC.
A.c(C1-)=c(NH4+)>c(H+)=c(OH-)B.c(C1-)>c(NH4+)=c(H+)>c(OH-)
C.c(NH4+)>c(OH-)>c(C1-)>c(H+)D.c(OH-)>c(NH4+)>c(H+)>c(C1-)
| 实验编号 | 氨水物质的量浓度/ (mol•L-1) | 盐酸物质的量浓度/ (mol•L-1) | 混合溶液pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
(1)从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)=1×10-5mol•L-1;从第②组情况表明,c (填“>”“<”或“=”)0.2mol•L-1;从第③组情况分析可知,混合溶液中c(NH4+)>(填“>”“<”或“=”)c(NH3•H2O).
(2)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下面图象正确的是B(填图象符号).

(3)向25mL 0.10mol•L-l的盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是ABC.
A.c(C1-)=c(NH4+)>c(H+)=c(OH-)B.c(C1-)>c(NH4+)=c(H+)>c(OH-)
C.c(NH4+)>c(OH-)>c(C1-)>c(H+)D.c(OH-)>c(NH4+)>c(H+)>c(C1-)
19.下列反应中必须加入还原剂才能进行的是( )
| A. | Mn2+→MnO${\;}_{4}^{-}$ | B. | NO${\;}_{3}^{-}$→NO | C. | H2→H2O | D. | Zn→Zn2+ |
9.下列溶液暴露在空气中不会变质的是( )
| A. | NaCl 溶液 | B. | NaOH 溶液 | C. | 氯水 | D. | Na2SO3 溶液 |
16.下列电子式错误的是( )
| A. | 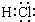 | B. | 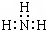 | C. | 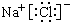 | D. |  |
13.下列实验操作和现象与结论关系不正确的是( )
| 操作和现象 | 结论 | |
| A. | 将大小相同的K和Na放入等体积的水中,钾比钠反应剧烈 | 钾元素的金属性比钠元素强 |
| B. | 将Ba(OH)2•8H2O和NH4Cl晶体在小烧杯中混合搅拌,用手触摸烧杯外壁感觉变凉 | Ba(OH)2•8H2O与NH4Cl的反应是吸热反应 |
| C. | 在催化剂存在的条件下,石蜡油加强热生成的气体通入溴的四氯化碳溶液中,溶液褪色 | 石蜡油的分解产物都是烯烃 |
| D. | 向盛有H2O2溶液的试管中,加入少量FeCl3溶液,产生气泡的速率比不加FeCl3溶液的快 | FeCl3可以加快H2O2分解的速率,起了催化作用 |
| A. | A | B. | B | C. | C | D. | D |
14.Cu+2FeCl3=CuCl2+2FeCl2的反应中,做氧化剂的是( )
| A. | Cu | B. | FeCl3 | C. | CuCl2 | D. | FeCl2 |

 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.