题目内容
14.Cu+2FeCl3=CuCl2+2FeCl2的反应中,做氧化剂的是( )| A. | Cu | B. | FeCl3 | C. | CuCl2 | D. | FeCl2 |
分析 Cu+2FeCl3=2FeCl2+CuCl2反应中Cu元素的化合价升高,Fe元素的化合价降低,结合氧化还原反应的概念分析.
解答 解:Cu+2FeCl3=2FeCl2+CuCl2反应中Cu元素的化合价升高,Cu被氧化,则Cu作还原剂,Fe元素的化合价降低,FeCl3是氧化剂,故选B.
点评 本题考查氧化还原反应,注意根据元素化合价的变化分析,侧重考查学生分析、推断能力,题目难度不大.

练习册系列答案
相关题目
9.如图所示的四组实验装置中,一般不用于分离物质的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
6.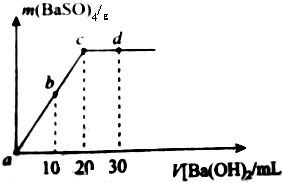 室温下,向20m1,物质的量浓度为0.35mol/L的H2SO4溶液中逐滴加人浓度的Ba(OH)2溶液,生成的沉淀与加人Ba(OH)2的体积如图(混合后体积变化忽略不计)下列说法不正确的是( )
室温下,向20m1,物质的量浓度为0.35mol/L的H2SO4溶液中逐滴加人浓度的Ba(OH)2溶液,生成的沉淀与加人Ba(OH)2的体积如图(混合后体积变化忽略不计)下列说法不正确的是( )
 室温下,向20m1,物质的量浓度为0.35mol/L的H2SO4溶液中逐滴加人浓度的Ba(OH)2溶液,生成的沉淀与加人Ba(OH)2的体积如图(混合后体积变化忽略不计)下列说法不正确的是( )
室温下,向20m1,物质的量浓度为0.35mol/L的H2SO4溶液中逐滴加人浓度的Ba(OH)2溶液,生成的沉淀与加人Ba(OH)2的体积如图(混合后体积变化忽略不计)下列说法不正确的是( )| A. | Ba(OH)2的物质的量浓密度为0.35mol/L | |
| B. | b时刻溶液中SO${\;}_{4}^{2-}$的浓度约为0.175mol/L | |
| C. | c时刻溶液显中性 | |
| D. | 实验过程中a、b、c三处溶液的导电能力c<b<a |
3.下列离子方程式表示正确的是( )
| A. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | 铜与浓硫酸混合加热:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO42-+2H2O+SO2↑ | |
| C. | 过量的浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 明矾溶液中滴加氢氧化钡溶液使沉淀质量最大:Al3++2SO42-+2Ba2++3OH-═2BaSO4↓+Al(OH)3↓ |
16.下列有关化学用语使用正确的是( )
| A. | 乙酸、葡萄糖、淀粉的最简式均为CH2O | |
| B. | 羟基的电子式为 | |
| C. | 乙醇分子的球棍模型为  | |
| D. | 2-羟基丁酸的键线式为 |

