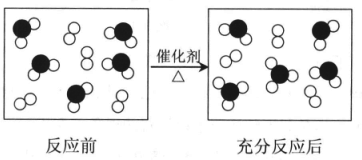
题目内容
9.下列溶液暴露在空气中不会变质的是( )| A. | NaCl 溶液 | B. | NaOH 溶液 | C. | 氯水 | D. | Na2SO3 溶液 |
分析 久置在空气中不易变质,说明该物质性质稳定,不易和空气中物质发生化学反应,据此分析解答.
解答 解:A、氯化钠性质稳定,不易和空气中物质反应,所以在空气中不易变质,故A正确;
B、NaOH 溶液和二氧化碳反应生成碳酸钠而变质,故B错误;
C.氯水中的次氯酸能分解产生盐酸和氧气,在空气中易变质,故C错误;
D.亚硫酸钠具有还原性,氧气具有氧化性,亚硫酸钠易被空气中氧气氧化而变质,故D错误;
故选A.
点评 本题考查了物质的存放,明确物质的性质是解本题关键,根据物质的氧化性和还原性、强酸制取弱酸来分析解答即可,难度不大.

练习册系列答案
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目
19.下列说法正确的是( )
| A. | H2、D2和T2互称为同素异形体 | B. | 35Cl和37Cl 互称为同位素 | ||
| C. |  和 和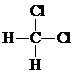 互称为同分异构体 互称为同分异构体 | D. | C2H4与C4H8一定能互称为同系物 |
20.锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门.以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如图:
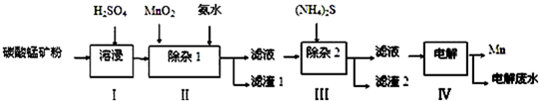
已知25℃,部分物质的溶度积常数如下:
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是MnCO3+H2SO4=MnSO4+CO2↑+H2O;
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③抑制Mn2+的水解;
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;加氨水调节溶液的pH为5.0~6.0,以除去Fe3+.
(4)步骤Ⅲ中,需要用到的玻璃仪器除玻璃棒、漏斗外,还有烧杯;滤渣2的主要成分是CoS和NiS;
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降.欲使溶液中c(Mn2+)≤1.0×10-5 mol•L-1,则应保持溶液中c(S2-)≥1.0×10-6 mol•L-1.

已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③抑制Mn2+的水解;
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;加氨水调节溶液的pH为5.0~6.0,以除去Fe3+.
(4)步骤Ⅲ中,需要用到的玻璃仪器除玻璃棒、漏斗外,还有烧杯;滤渣2的主要成分是CoS和NiS;
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降.欲使溶液中c(Mn2+)≤1.0×10-5 mol•L-1,则应保持溶液中c(S2-)≥1.0×10-6 mol•L-1.
17.某物质灼烧时,焰色反应为黄色,下列判断正确的是( )
| A. | 该物质一定是钠的化合物 | B. | 该物质一定是金属钠 | ||
| C. | 该物质一定含钠元素 | D. | 可确定该物质中不含钾元素 |
14.下列离子方程式书写正确的是( )
| A. | 铁跟稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 钠跟水反应 Na+H2O═Na++OH-+H2↑ | |
| C. | 大理石跟稀盐酸反应 CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 氯气通入水中 Cl2+H2O═2H++Cl-+ClO- |
1.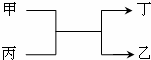 甲、乙为短周期同一主族元素的单质,丙、丁为氧化物,它们存在如图转化关系,下列各组的甲和乙一定符合的是( )
甲、乙为短周期同一主族元素的单质,丙、丁为氧化物,它们存在如图转化关系,下列各组的甲和乙一定符合的是( )
 甲、乙为短周期同一主族元素的单质,丙、丁为氧化物,它们存在如图转化关系,下列各组的甲和乙一定符合的是( )
甲、乙为短周期同一主族元素的单质,丙、丁为氧化物,它们存在如图转化关系,下列各组的甲和乙一定符合的是( )| A. | 钠和氢 | B. | 氧和硫 | C. | 碳和硅 | D. | 氟和氯 |