题目内容
8. 已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol•L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD(填字母).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E.$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:ClO-+H2O+CO2=HCO3-+HClO.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(填准确数值).
(5)25℃时,将a mol•L-1的醋酸与b mol•L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为$\frac{b×10-7}{a-b}$.
(6)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.
(7)标准状况下,将1.12L CO2通入100mL 1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+).
②c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-).
分析 (1)弱酸的电离平衡常数越大,其酸性越强,其酸根的水解程度越弱;
(2)0.1mol/L的CH3COOH溶液加水稀释过程中,氢离子与醋酸根离子物质的量增大,醋酸分子物质的量减小,浓度减小,酸性减弱,水的离子积常数不变,醋酸的电离平衡常数不变;
(3)次氯酸酸性大于碳酸氢根离子,反应生成碳酸氢钠和次氯酸;
(4)根据溶液中的电荷守恒和物料守恒来计算;
(5)将a mol•L-1的醋酸溶液与b mol•L-1的氢氧化钠溶液等体积混合,溶液呈中性,说明醋酸过量,醋酸和氢氧化钠溶液发生反应CH3COOH+NaOH=CH3COONa+H2O,则溶液中c(CH3COOH)=$\frac{a-b}{2}$mol•L-1,达到电离平衡时,溶液呈中性,氢离子浓度是1×10-7mol•L-1,c(Na+)=c(CH3COO-)=$\frac{b}{2}$mol•L-1,则k=$\frac{C(C{H}_{3}CO{O}^{-})×C({H}^{+})}{C(C{H}_{3}COOH)}$=$\frac{b×10-7}{a-b}$;
(6)pH相等的酸中,加水稀释促进弱酸电离,稀释相同的倍数,pH变化大的为强酸,小的为弱酸;
(7)①根据质子守恒分析解答;②根据溶液中的电荷守恒书写.
解答 解:(1)据电离平衡常数可知,酸性由强到弱的顺序为:CH3COOH>H2CO3>HClO>HCO3-,弱酸的酸性越弱其酸根离子的水解程度越大,溶液碱性越强,所以pH由小到大排列顺序是a<d<c<b,故答案为:a<d<c<b;
(2)0.1mol/L的CH3COOH溶液加水稀释过程中,氢离子与醋酸根离子物质的量增大,浓度减小,酸性减弱,A、氢离子浓度减小,故错误;
B、加水稀释过程中,氢离子物质的量增大,醋酸分子物质的量减小,所以$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大,故正确;
C、水的离子积常数不变,故错误;
D、醋酸溶液加水稀释时酸性减弱,氢离子浓度减小氢氧根离子浓度增大,所以$\frac{c(O{H}^{-})}{c({H}^{+})}$ 增大,故正确;
E、醋酸的电离平衡常数不变,故错误;
故答案为:BD;
(3)次氯酸的酸性强于碳酸氢根离子离子,反应生成碳酸氢根离子,反应的离子方程式为:ClO-+H2O+CO2=HCO3-+HClO,故答案为:ClO-+H2O+CO2=HCO3-+HClO;(4)CH3COOH与CH3COONa的混合溶液中,存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6mol/L-10-8mol/L=9.9×10-7mol/L,
故答案为:9.9×10-7mol•L-1;
(5)将amol•L-1的醋酸溶液与b mol•L-1的氢氧化钠溶液等体积混合,溶液呈中性,说明醋酸过量,醋酸和氢氧化钠溶液发生反应CH3COOH+NaOH=CH3COONa+H2O,则溶液中c(CH3COOH)=$\frac{a-b}{2}$mol•L-1,达到电离平衡时,溶液呈中性,氢离子浓度是1×10-7mol•L-1,c(Na+)=c(CH3COO-)=$\frac{b}{2}$mol•L-1,则k=$\frac{C(C{H}_{3}CO{O}^{-})×C({H}^{+})}{C(C{H}_{3}COOH)}$=$\frac{b×10-7}{a-b}$,故答案为:$\frac{b×10-7}{a-b}$;
(6)pH相等的酸中,加水稀释促进弱酸电离,稀释相同的倍数,pH变化大的为强酸,小的为弱酸,所以HX的酸性大于醋酸,则HX的电离平衡常数大于醋酸,
故答案为:大于;
(7)标准状况下,将1.12L CO2通入100mL 1mol•L-1的NaOH溶液中,1.12L CO2的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,氢氧化钠的物质的量为:1mol•L-1×0.1L=0.1mol,二者恰好完全反应生成碳酸钠,质子守恒得:c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+);电荷守恒:c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-),故答案为:①c(HCO3-)+c(H+);②2c(CO32-)+c(HCO3-)+c(OH-).
点评 本题考查了弱电解质的电离,明确弱电解质的电离特点、电离平衡常数与酸根离子水解程度的关系再结合守恒思想分析解答,(7)题要先判断溶液中的溶质,再结合离子水解程度相对大小判断离子浓度,难度中等.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案| A. | Pb是正极 | B. | PbO2得电子,被氧化 | ||
| C. | 负极反应是:Pb-2e-+SO42-=PbSO4 | D. | 电池放电时,溶液酸性增强 |
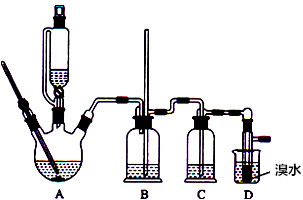
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
(2)装置B的作用是防止倒吸,判断装置是否堵塞.
(3)在装置C中应加入c(填字母).
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)若产物中有少量未反应的Br2,最好用e(填字母)洗涤除去.
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 其阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(2)工业制取D单质的化学方程式为:2Al 2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
(3)D单质和C的最高价氧化物对应的水化物反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)实验室制取E单质的离子方程式为:MnO2+4 H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
| A. | 医用消毒酒精的体积分数为75% | |
| B. | 常用稀释的福尔马林溶液保存动物标本 | |
| C. | 新制的氢氧化铜悬浊液可用于于检验病人的尿糖 | |
| D. | 工业上常用乙烷和氯气反应制取氯乙烷 |

| A. | 装置甲:用CCl4萃取碘水中的碘 | |
| B. | 装置乙:加热碘的CCl4溶液,分离碘并回收CCl4 | |
| C. | 装置丙:验证硫酸、碳酸、苯酚溶液的酸性 | |
| D. | 用乙酸、乙醇制取乙酸乙酯 |
| A. | NaOH溶液 | B. | Ba(OH)2溶液 | C. | BaCl2溶液 | D. | AgNO3溶液 |
| A. | C、O | B. | N、P | C. | Mg、Al | D. | Na、Na+ |