题目内容
20.下列有关实验存在不合理的装置是( )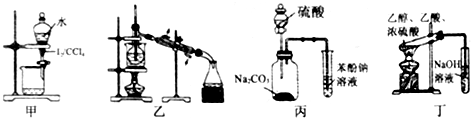
| A. | 装置甲:用CCl4萃取碘水中的碘 | |
| B. | 装置乙:加热碘的CCl4溶液,分离碘并回收CCl4 | |
| C. | 装置丙:验证硫酸、碳酸、苯酚溶液的酸性 | |
| D. | 用乙酸、乙醇制取乙酸乙酯 |
分析 A.萃取剂的选择必须符合下列条件:溶质在萃取剂中的溶解度比在原溶剂中要大;萃取剂与原溶剂不相溶;萃取剂与溶质不反应;
B.碘易升华,蒸馏时,测定馏分的温度;
C.发生强酸制取弱酸的反应;
D.乙酸乙酯在氢氧化钠中能发生水解.
解答 解:A.CCl4和水不互溶,且CCl4和碘不反应,故A正确;
B.碘易升华,蒸馏时,冷凝管应从下端进水,上端出水,但温度计的水银球应在支管口处,故B错误;
C.发生强酸制取弱酸的反应,由装置及发生的反应可知,酸性为硫酸>碳酸>苯酚,故C正确;
D.乙酸乙酯在氢氧化钠中能发生水解,应用饱和碳酸钠,故D错误.
故选BD.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.

练习册系列答案
 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
15.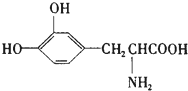 L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如图:这种药物的研制是基于获得2000年诺贝尔生理学或医学奖、2001年诺贝尔化学奖的研究成果.下列关于L-多巴的叙述正确的是( )
L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如图:这种药物的研制是基于获得2000年诺贝尔生理学或医学奖、2001年诺贝尔化学奖的研究成果.下列关于L-多巴的叙述正确的是( )
 L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如图:这种药物的研制是基于获得2000年诺贝尔生理学或医学奖、2001年诺贝尔化学奖的研究成果.下列关于L-多巴的叙述正确的是( )
L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如图:这种药物的研制是基于获得2000年诺贝尔生理学或医学奖、2001年诺贝尔化学奖的研究成果.下列关于L-多巴的叙述正确的是( )| A. | 只能与碱反应,不能与酸反应 | |
| B. | 1mol该物质最多与4molNaOH反应 | |
| C. | 该物质不能使酸性KMnO4褪色 | |
| D. | 1mol该物质最多可与1.5molHBr反应 |
8. 已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol•L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD(填字母).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E.$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:ClO-+H2O+CO2=HCO3-+HClO.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(填准确数值).
(5)25℃时,将a mol•L-1的醋酸与b mol•L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为$\frac{b×10-7}{a-b}$.
(6)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.
(7)标准状况下,将1.12L CO2通入100mL 1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+).
②c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-).
 已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol•L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD(填字母).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E.$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:ClO-+H2O+CO2=HCO3-+HClO.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(填准确数值).
(5)25℃时,将a mol•L-1的醋酸与b mol•L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为$\frac{b×10-7}{a-b}$.
(6)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.
(7)标准状况下,将1.12L CO2通入100mL 1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+).
②c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-).
15.下列有机物的命名正确的是( )
| A. | 2-羟基苯甲酸 | B. | 三丙醇(俗名甘油) | C. | 2-乙基庚烷 | D. | 2-乙基-2-丁烯 |
10.以下电子排布式表示基态原子电子排布的是( )
| A. | 1s22s22p63s13p3 | B. | 1s22s22p63s23p63d104s14p1 | ||
| C. | 1s22s22p63s23p63d24s2 | D. | 1s22s22p63s23p63d104s14p2 |
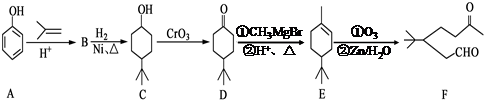
 .
.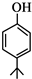 .同时满足下列条件的B的同分异构体(不包括B)共有11种:
.同时满足下列条件的B的同分异构体(不包括B)共有11种: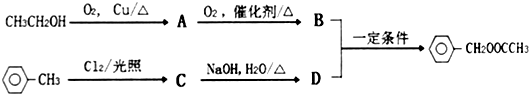
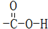 .
.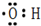 .
.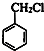 ,D的名称是苯甲醇.
,D的名称是苯甲醇. .
.