题目内容
9.(1)MgCl2•6H2O晶体受热水解可以生成MgOHCl,但产率较低,其化学方程式为MgCl2•6 H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+HCl↑+5 H2O.I.先用空气得到氮气,可供选择的装置和药品如图1(还原铁粉已干燥,装置内发生的反应是完全的).
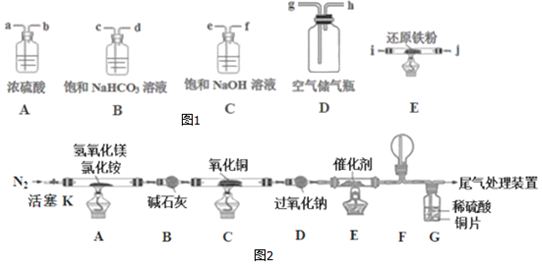
(2)连接并检查装置的气密性.实验开始时,打开自来水的开关,将空气从5L的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)h→e→f→a→b→i→j.
II.将得到的氮气通入如图装置参与制备碱式氯化镁并探究氨的催化氧化反应(其中CuO的质量为8.0g).
(3)装置A中发生反应生成碱式氯化镁的化学方程为Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O.
(4)实验结束时进行正确操作是C.
A.关闭活塞K,先熄灭A处酒精灯,后熄灭C、E处酒精灯
B.先熄灭A处酒精灯,关闭活塞K,后熄灭C、E处酒精灯
C.先熄灭A处酒精灯,再熄灭C、E处酒精灯,后关闭活塞K
(5)反应完毕,装置C中的氧化铜完全反应,由黑色变为红色,甲同学设计一个实验方案,证明装置C中完全反应后的红色固体中含Cu2O.己知:①Cu2O+H+═Cu2++Cu;②限选试剂:2mol/L H2SO4溶液、12mol/L H2SO4溶液、2mol/L HNO3溶液、10mol/L HNO3溶液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取装置C中反应后的少许固体于试管中 | |
| 步骤2: 向试管中加入2mol/LH2SO4溶液 | 溶液中出现蓝色,说明红色固体中含有Cu2O,Cu和Cu2O |
分析 Ⅰ.(1)MgCl2•6H2O晶体受热水解可以生成MgOHCl,结合原子守恒得到反应生成产物中有HCl和水;
(2)根据先除杂后干燥的原理及固体加热试管必须干燥的原理可将装置进行排序.气体参与的物质制备实验中装置的连接一般顺序是:制备气体→除杂→干燥→制备→尾气处理;
Ⅱ.A中反应得到MgOHCl,还生成NH3与H2O,碱石灰干燥氨气,C中氨气与氧化铜反应会得到氮气与水,D最过氧化钠水反应生成氧气,D中氨气与氧气发生催化氧化,F中NO与氧气反应得到二氧化氮,G中二氧化氮溶解得到硝酸,硝酸与Cu反应,
(3)氢氧化镁与氯化铵再加热条件下反应生成MgOHCl、NH3与H2O;
(4)装置C中氧化铁被还原生成铜,若遇到热空气会生成黑色固体氧化铜,熄灭酒精灯后需要持续通入氮气;
(5)Cu能与浓硫酸反应,应用稀H2SO4溶液溶解,溶液中出现蓝色,说明红色固体中含有Cu2O;红色物质为Cu或Cu2O或二者混合物,固体质量减少质量为减少的氧元素质量,再计算CuO中氧元素质量,可以判断红色固体的组成,根据Cu元素守恒、红色固体总质量计算组成物质的量,进而计算转移电子.
解答 解:Ⅰ.(1)MgCl2•6H2O晶体受热水解可以生成MgOHCl,结合原子守恒得到反应生成产物中有HCl和水,反应的化学方程式为:MgCl2•6 H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+HCl↑+5 H2O,
故答案为:MgCl2•6 H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+HCl↑+5 H2O;
(2)气体参与的物质制备实验中装置的连接一般顺序是:制备气体→除杂→干燥→制备→尾气处理,所以除去空气中的O2、CO2、H2O制备氮化镁,装置连接顺序是e→f→a→b→i→j,
故答案为:e→f→a→b→i→j;
Ⅱ.A中反应得到MgOHCl,还生成NH3与H2O,碱石灰干燥氨气,C中氨气与氧化铜反应会得到氮气与水,D最过氧化钠水反应生成氧气,D中氨气与氧气发生催化氧化,F中NO与氧气反应得到二氧化氮,G中二氧化氮溶解得到硝酸,硝酸与Cu反应.
(3)氢氧化镁与氯化铵再加热条件下反应生成MgOHCl、NH3与H2O,反应方程式为:Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O,
故答案为:Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O;
(4)装置C中氧化铁被还原生成铜,若遇到热空气会生成黑色固体氧化铜,熄灭酒精灯后需要持续通入氮气,实验结束时进行正确操作是:先熄灭A处酒精灯,再熄灭C、E处酒精灯,后关闭活塞K,故选C,
故答案为:C;
(5)Cu能与浓硫酸反应,Cu2O能与稀酸反应得到Cu2+,用稀H2SO4溶液溶解,溶液中出现蓝色,说明红色固体中含有Cu2O,Cu和Cu2O,
红色物质为Cu或Cu2O或二者混合物,固体质量减少质量为减少的氧元素质量,则减少的氧元素质量为8g-6.8g=1.2g,而CuO中氧元素质量为8.0g×$\frac{16}{80}$=1.6g>1.2g,故红色固体为Cu、Cu2O混合物,设二者物质的量分别为xmol、ymol,
则:x+2y=$\frac{8}{80}$
64x+144y=6.8,
解得x=0.05,y=0.025,
则转移电子为0.05mol×2+0.025mol×2=0.15mol,
故答案为:
| 实验步骤 | 预期现象和结论 |
| \ | |
| 向试管中加入2mol/LH2SO4溶液 | 溶液中出现蓝色,说明红色固体中含有Cu2O,Cu和Cu2O |
点评 本题考查物质的制备及性质探究实验,关键是理解各装置作用,熟练掌握元素化合物性质,注意利用氧元素质量变化判断固体组成,也可以利用Cu元素质量确定,充分利用题目信息进行实验设计,题目难度中等.

| A. | 通氢气的一极是正极,通氧气的一极是负极 | |
| B. | 通氢气的一极发生的是还原反应 | |
| C. | 工作一段时间后电解质溶液的pH值减小 | |
| D. | 工作时负极区附近的pH值增大 |
| A. | 黄砷中共价键键能大于白磷 | B. | 黄砷的熔点高于白磷 | ||
| C. | 黄砷易溶于水 | D. | 分子中共价键键角均为109°28′ |
| A. | 向MgCl2溶液中滴加少量NaOH溶液,产生白色沉淀,再滴加FeCl3溶液,沉淀逐渐变为红褐色 | |
| B. | 氯化亚铁不能通过化合反应制得 | |
| C. | 用0.1mol/L的酸性KMnO4溶液配成的溶液滴定一定质量的草酸晶体(H2C2O4•nH2O)以测定其n值,若终点仰视读数,则n值偏小 | |
| D. | 将稀硫酸由室温加热至80℃(忽略溶液体积变化),其pH不变 |
| A. | 都易溶于水 | |
| B. | 苯易挥发不能用作溶剂 | |
| C. | 乙醇和乙酸反应的有机产物的同分异构体中属于酯类的有4种 | |
| D. | CH3CH2OH→CH3CHO发生了加成反应 |
| A. | 含有等物质的量的AlO2-,OH-,CO32-的溶液中逐滴加入盐酸:AlO2-,OH-,CO32- | |
| B. | 含有等物质的量的FeBr2和FeI2溶液中缓缓通入Cl2:I-,Br-,Fe2+ | |
| C. | 在等物质的量的Ba(OH)2和KOH溶液中缓缓通入CO2:KOH,Ba(OH)2,BaCO3 | |
| D. | 在含有等物质的量的Fe3+、Ag+、Cu2+、H+、Fe2+的溶液中逐渐加入锌粉:Ag+、Fe3+、Cu2+、H+、Fe2+ |
| A. | 混合物:铝热剂、液氨、铝合金、酒精 | |
| B. | 化合物:干冰、冰水混合物、烧碱、小苏打 | |
| C. | 电解质:氯化钠、硫酸钡、氯化氢、水 | |
| D. | 同素异形体:活性炭、C60、石墨烯、金刚石 |
| A. | 加热固体,用湿润的红色石蕊试纸靠近,看颜色变化,用此法鉴别固体是否为铵盐 | |
| B. | 用短胶头滴管向FeSO4溶液滴加NaOH溶液,产生的白色沉淀可长时间存在 | |
| C. | 将金属钠投入CuSO4溶液,可观察到有红色固体析出 | |
| D. | 向25mL沸腾的蒸馏水中逐滴加入5-6滴FeCl3饱和溶液,继续煮沸至溶液红褐色,停止加热,便得到Fe(OH)3胶体 |
