题目内容
6.在复杂的体系中,研究化学反应的先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是( )| A. | 含有等物质的量的AlO2-,OH-,CO32-的溶液中逐滴加入盐酸:AlO2-,OH-,CO32- | |
| B. | 含有等物质的量的FeBr2和FeI2溶液中缓缓通入Cl2:I-,Br-,Fe2+ | |
| C. | 在等物质的量的Ba(OH)2和KOH溶液中缓缓通入CO2:KOH,Ba(OH)2,BaCO3 | |
| D. | 在含有等物质的量的Fe3+、Ag+、Cu2+、H+、Fe2+的溶液中逐渐加入锌粉:Ag+、Fe3+、Cu2+、H+、Fe2+ |
分析 A.盐酸先和氢氧根离子反应;
B.还原性越强的微粒越先反应;
C.先发生钡离子与CO2反应再发生OH-与CO2反应;
D.氧化性越强的微粒越先反应.
解答 解:A.含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸,反应的先后OH-、AlO2-、CO32-、Al(OH)3,故A错误;
B.含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2,离子的还原性强弱顺序是I-、Fe2+、Br-,所以反应的先后为I-、Fe2+、Br-,故B错误;
C.含等物质的量的Ba(OH)2、KOH的溶液中通入CO2,先后顺序为Ba(OH)2、KOH、BaCO3,故C错误;
D.氧化性由大到小的顺序为Ag+>Fe3+>Cu2+>H+>Fe2+,含有等物质的量的Fe3+、Ag+、Cu2+、H+、Fe2+的溶液中逐渐加入锌粉,离子反应的先后顺序为:Ag+、Fe3+、Cu2+、H+、Fe2+,故D正确;
故选D.
点评 本题考查物质的性质,为高频考点,把握氧化还原反应的先后顺序、中和反应的先后顺序为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.下列关于能源的叙述错误的是( )
| A. | 人类目前所直接利用的能量大部分是由化学反应产生的 | |
| B. | 氢氧燃料电池工作过程中,热能转变为电能 | |
| C. | 电解水制取H2过程中,电能转变为化学能 | |
| D. | 生物质能源是可再生能源 |
9.(1)MgCl2•6H2O晶体受热水解可以生成MgOHCl,但产率较低,其化学方程式为MgCl2•6 H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+HCl↑+5 H2O.
I.先用空气得到氮气,可供选择的装置和药品如图1(还原铁粉已干燥,装置内发生的反应是完全的).
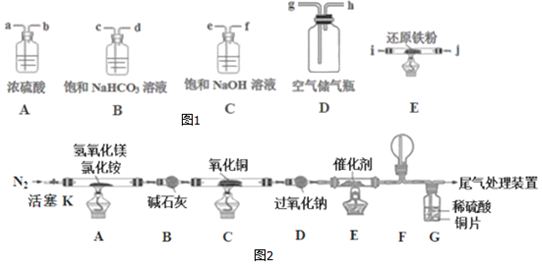
(2)连接并检查装置的气密性.实验开始时,打开自来水的开关,将空气从5L的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)h→e→f→a→b→i→j.
II.将得到的氮气通入如图装置参与制备碱式氯化镁并探究氨的催化氧化反应(其中CuO的质量为8.0g).
(3)装置A中发生反应生成碱式氯化镁的化学方程为Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O.
(4)实验结束时进行正确操作是C.
A.关闭活塞K,先熄灭A处酒精灯,后熄灭C、E处酒精灯
B.先熄灭A处酒精灯,关闭活塞K,后熄灭C、E处酒精灯
C.先熄灭A处酒精灯,再熄灭C、E处酒精灯,后关闭活塞K
(5)反应完毕,装置C中的氧化铜完全反应,由黑色变为红色,甲同学设计一个实验方案,证明装置C中完全反应后的红色固体中含Cu2O.己知:①Cu2O+H+═Cu2++Cu;②限选试剂:2mol/L H2SO4溶液、12mol/L H2SO4溶液、2mol/L HNO3溶液、10mol/L HNO3溶液.
乙同学称量C中红色物质,质量为6.8g,且生成的气体可直接排放到大气中,进一步确定红色固体是Cu和Cu2O,该反应中电子转移的物质的量为0.15mol.
I.先用空气得到氮气,可供选择的装置和药品如图1(还原铁粉已干燥,装置内发生的反应是完全的).

(2)连接并检查装置的气密性.实验开始时,打开自来水的开关,将空气从5L的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)h→e→f→a→b→i→j.
II.将得到的氮气通入如图装置参与制备碱式氯化镁并探究氨的催化氧化反应(其中CuO的质量为8.0g).
(3)装置A中发生反应生成碱式氯化镁的化学方程为Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O.
(4)实验结束时进行正确操作是C.
A.关闭活塞K,先熄灭A处酒精灯,后熄灭C、E处酒精灯
B.先熄灭A处酒精灯,关闭活塞K,后熄灭C、E处酒精灯
C.先熄灭A处酒精灯,再熄灭C、E处酒精灯,后关闭活塞K
(5)反应完毕,装置C中的氧化铜完全反应,由黑色变为红色,甲同学设计一个实验方案,证明装置C中完全反应后的红色固体中含Cu2O.己知:①Cu2O+H+═Cu2++Cu;②限选试剂:2mol/L H2SO4溶液、12mol/L H2SO4溶液、2mol/L HNO3溶液、10mol/L HNO3溶液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取装置C中反应后的少许固体于试管中 | |
| 步骤2: 向试管中加入2mol/LH2SO4溶液 | 溶液中出现蓝色,说明红色固体中含有Cu2O,Cu和Cu2O |
11.在如图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )

| A. | 碳棒上有气体放出,溶液pH变小 | |
| B. | a是正极,b是负极 | |
| C. | 导线中有电子流动,外电路中,电流从a极到b极 | |
| D. | a极上发生了氧化反应 |
15.如图所示的实验操作不正确的是( )
| A. |  铁丝在氧气中燃烧 | B. |  读取液体的体积 | ||
| C. |  除去CO中的CO2 | D. |  制取蒸馏水 |
16.实验室可以按如图所示的装置干燥、贮存气体M,多余的气体可用水吸收,则M是( )


| A. | 氨气 | B. | 一氧化碳 | C. | 二氧化氮 | D. | 氯化氢 |
 .
.
