题目内容
19.氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%-40%的KOH溶液的多孔碳电极,其电池反应为2H2+4OH--4e-═4H2O和O2+2H2O+4e-═4OH-,则下列叙述正确的( )| A. | 通氢气的一极是正极,通氧气的一极是负极 | |
| B. | 通氢气的一极发生的是还原反应 | |
| C. | 工作一段时间后电解质溶液的pH值减小 | |
| D. | 工作时负极区附近的pH值增大 |
分析 氢氧燃料电池是将化学能转变为电能的装置,工作时,通入氢气的一极为电池的负极,发生氧化反应,通入氧气的一极为电池的正极,发生还原反应,电池总反应与氢气在氧气中燃烧的化学方程式一致,产物为水.
解答 解:A、在燃料电池中,通入燃料氢气的一极为电池的负极,通入氧气的一极是正极,故A错误;
B、在燃料电池中,通入燃料氢气的一极为电池的负极,发生氧化反应,故B错误;
C、氢氧燃料电池总反应与氢气在氧气中燃烧的化学方程式一致,产物为水,工作一段时间后电解质溶液碱性减弱,pH减小,故C正确;
D、氢氧燃料电池中通入氢气的一极为电池的负极,发生氧化反应,电极反应为:2H2+4OH--4e-═4H2O,负极区附近pH减小,故D错误.
故选C.
点评 本题主要考查原电池的工作原理,根据得失电子确定正负极,题目难度不大,注意电极反应式的书写.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列关于有机化合物的叙述正确的是( )
| A. | 分子式为C3H6Cl2的有机物有4种同分异构体 | |
| B. | 包装用材料聚氯乙烯分子中含有碳碳双键 | |
| C. | 苯与液溴混合后加入铁粉发生了加成反应 | |
| D. | 1mol苹果酸(HOOCCHOHCH2COOH)可与3molNaHCO3发生反应 |
14.针对实验室制取氨气,下列说法错误的是( )
| A. | 发生装置与用KClO3制取O2的装置相同 | |
| B. | 可用浓硫酸干燥氨气 | |
| C. | 可用向下排空气法收集氨气 | |
| D. | 氨气的验满可以用蘸有浓盐酸的玻璃棒放于试管口附近 |
8.短周期主族元素X、Y、Z、W的原子序数依次增大,X的氢化物极易溶于Y的氢化物中,常温下Z的单质能溶于X的最高价氧化物对应的水化物的稀溶液中,不溶于其浓溶液中,W元素的最高正价与最低负价代数和为+4,下列说法正确的是( )
| A. | 钠与W可以形成Na2W2化合物 | |
| B. | Z与少量的氢氧化钠溶液反应生成两性氢氧化物 | |
| C. | X与氢元素只能形成含共价键的化合物 | |
| D. | WO2与XO2均为酸性氧化物 |
9.(1)MgCl2•6H2O晶体受热水解可以生成MgOHCl,但产率较低,其化学方程式为MgCl2•6 H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+HCl↑+5 H2O.
I.先用空气得到氮气,可供选择的装置和药品如图1(还原铁粉已干燥,装置内发生的反应是完全的).
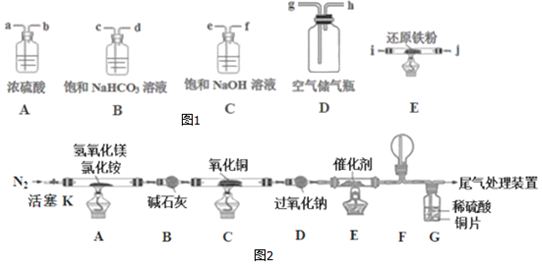
(2)连接并检查装置的气密性.实验开始时,打开自来水的开关,将空气从5L的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)h→e→f→a→b→i→j.
II.将得到的氮气通入如图装置参与制备碱式氯化镁并探究氨的催化氧化反应(其中CuO的质量为8.0g).
(3)装置A中发生反应生成碱式氯化镁的化学方程为Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O.
(4)实验结束时进行正确操作是C.
A.关闭活塞K,先熄灭A处酒精灯,后熄灭C、E处酒精灯
B.先熄灭A处酒精灯,关闭活塞K,后熄灭C、E处酒精灯
C.先熄灭A处酒精灯,再熄灭C、E处酒精灯,后关闭活塞K
(5)反应完毕,装置C中的氧化铜完全反应,由黑色变为红色,甲同学设计一个实验方案,证明装置C中完全反应后的红色固体中含Cu2O.己知:①Cu2O+H+═Cu2++Cu;②限选试剂:2mol/L H2SO4溶液、12mol/L H2SO4溶液、2mol/L HNO3溶液、10mol/L HNO3溶液.
乙同学称量C中红色物质,质量为6.8g,且生成的气体可直接排放到大气中,进一步确定红色固体是Cu和Cu2O,该反应中电子转移的物质的量为0.15mol.
I.先用空气得到氮气,可供选择的装置和药品如图1(还原铁粉已干燥,装置内发生的反应是完全的).

(2)连接并检查装置的气密性.实验开始时,打开自来水的开关,将空气从5L的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)h→e→f→a→b→i→j.
II.将得到的氮气通入如图装置参与制备碱式氯化镁并探究氨的催化氧化反应(其中CuO的质量为8.0g).
(3)装置A中发生反应生成碱式氯化镁的化学方程为Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O.
(4)实验结束时进行正确操作是C.
A.关闭活塞K,先熄灭A处酒精灯,后熄灭C、E处酒精灯
B.先熄灭A处酒精灯,关闭活塞K,后熄灭C、E处酒精灯
C.先熄灭A处酒精灯,再熄灭C、E处酒精灯,后关闭活塞K
(5)反应完毕,装置C中的氧化铜完全反应,由黑色变为红色,甲同学设计一个实验方案,证明装置C中完全反应后的红色固体中含Cu2O.己知:①Cu2O+H+═Cu2++Cu;②限选试剂:2mol/L H2SO4溶液、12mol/L H2SO4溶液、2mol/L HNO3溶液、10mol/L HNO3溶液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取装置C中反应后的少许固体于试管中 | |
| 步骤2: 向试管中加入2mol/LH2SO4溶液 | 溶液中出现蓝色,说明红色固体中含有Cu2O,Cu和Cu2O |
 D在周期表的位置:第三周期VIIA族.
D在周期表的位置:第三周期VIIA族.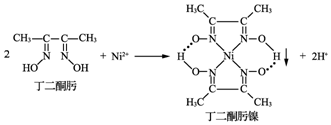
 .
.
 .
.