题目内容
1.氢氧燃料电池已用于航天飞机,以30%KOH溶液为电解质溶液.电极反应如下:2H2+4OH--4e-=4H2O,O2+2H2O+4e-=4OH-.据此作出判断,下列说法中不正确的是( )| A. | O2在正极发生还原反应 | B. | 供电时的总反应为2H2+O2═2H2O | ||
| C. | 燃料电池的能量转化率可达100% | D. | 氢氧燃料电池属于环境友好电池 |
分析 氢氧燃料电池是将化学能转变为电能的装置,工作时,通入氢气的一极为电池的负极,发生氧化反应,通入氧气的一极为电池的正极,发生还原反应,电池总反应与氢气在氧气中燃烧的化学方程式一致,产物为水,对环境无污染.
解答 解:A、由电极反应式可知,通入氧气的一极为电池的正极,发生还原反应,故A正确;
B、电池总反应与氢气在氧气中燃烧的化学方程式一致,总反应为2H2+O2═2H2O,故B正确;
C、燃料电池的能量转化率高,能量转换率可达80%,但是不可能为100%,故C错误;
D、氢氧燃料电池产物是水,对环境物污染,属于环境友好电池,故D正确.
故选C.
点评 本题考查原电池的组成以及工作原理,题目难度不大,注意电极反应式以及电极反应的产物.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.现有三组混合液:①乙酸乙酯和乙酸钠溶液 ②乙醇和丁醇 ③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液 蒸馏 萃取 | B. | 萃取 蒸馏 分液 | ||
| C. | 分液 萃取 蒸馏 | D. | 蒸馏 萃取 分液 |
12.下列物质中能与烧碱溶液发生氧化还原反应的是( )
| A. | CuSO4 | B. | CO2 | C. | NH4Cl | D. | Al |
9.在下列由2-氯丙烷制取少量的 的步骤中,合理的是( )
的步骤中,合理的是( )
 的步骤中,合理的是( )
的步骤中,合理的是( )| A. | 加成→消去→取代 | B. | 消去→取代→水解 | C. | 消去→加成→取代 | D. | 取代→消去→加成 |
6.某化学兴趣小组为探究卤族元素中氯、溴、碘的非金属性强弱,进行了如下实验,完成下表:
由以上结论可知,三种元素的非金属性由强到弱的顺序是Cl>Br>I.
| 实验操作 | 实验现象 | 离子方程式 | 单质氧化性 |
| 向NaBr溶液中滴入氯水,一段时间后再加入CCl4 | 静置后,液体分层,上层接近无色,下层橙红色 | 2Br-+Cl2=2 Cl-+Br2 | Cl2>Br2 |
| 向KI溶液中滴入氯水,一段时间后再加入CCl4 | 静置后,液体分层,上层接近无色,下层紫色 | 2I-+Cl2=2 Cl-+I2 | Cl2>I2 |
| 向KI溶液中滴入溴水,一段时间后再加入CCl4 | 静置后,液体分层,上层接近无色,下层紫色 | 2I-+Br2=2 Br-+I2 | Br2>I2 |
13.反应2A(g)+3B(g)=2C(g)+D(g)在四种不同情况下的反应速率如下,其中反应速率v最大的是( )
| A. | v(A)=0.75mol/(L•s) | B. | v(B)=0.6mol/(L•s) | C. | v(C)=1.0mol/(L•s) | D. | v(D)=0.8mol/(L•s) |
10.下列关于钠及其氧化物的叙述中正确的是( )
| A. | 钠着火后,可用泡沫灭火器来灭火 | |
| B. | 氧化钠和过氧化钠都属于碱性氧化物 | |
| C. | 氧化钠和过氧化钠的组成元素相同,都可以与CO2反应且产物相同 | |
| D. | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应 |
 有一Na2SO3固体因部分被氧化而变质.为测定样品纯度,甲、乙两位同学分别设计了如下实验方案:
有一Na2SO3固体因部分被氧化而变质.为测定样品纯度,甲、乙两位同学分别设计了如下实验方案: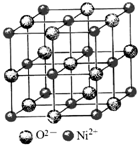 高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.
高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.