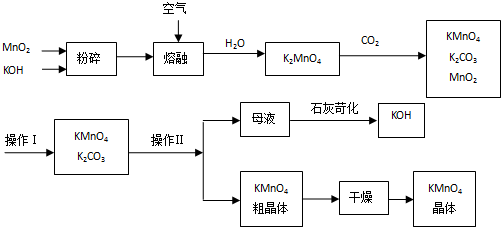
题目内容
6.某化学兴趣小组为探究卤族元素中氯、溴、碘的非金属性强弱,进行了如下实验,完成下表:| 实验操作 | 实验现象 | 离子方程式 | 单质氧化性 |
| 向NaBr溶液中滴入氯水,一段时间后再加入CCl4 | 静置后,液体分层,上层接近无色,下层橙红色 | 2Br-+Cl2=2 Cl-+Br2 | Cl2>Br2 |
| 向KI溶液中滴入氯水,一段时间后再加入CCl4 | 静置后,液体分层,上层接近无色,下层紫色 | 2I-+Cl2=2 Cl-+I2 | Cl2>I2 |
| 向KI溶液中滴入溴水,一段时间后再加入CCl4 | 静置后,液体分层,上层接近无色,下层紫色 | 2I-+Br2=2 Br-+I2 | Br2>I2 |
分析 元素的非金属性越强,其单质的氧化性越强,同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性;氯气能氧化溴离子生成溴单质,能氧化碘离子生成碘单质,溴能氧化碘离子生成碘单质,据此判断非金属性强弱.
解答 解:将少量氯水滴入NaBr溶液中,用力振荡后加入少量四氯化碳,振荡,静置,发现NaBr溶液分层,上层接近无色,下层溶液呈橙红色,说明氯气将溴离子氧化生成溴单质,离子反应方程式为Cl2+2Br-=2 Cl-+Br2;
将少量氯水滴入KI溶液中,用力振荡后加入少量四氯化碳,振荡,静置,发现KI溶液分层,上层接近无色,下层溶液呈紫色,说明氯气将碘离子氧化生成碘单质;
将少量溴水加入盛有KI溶液(试管③)中,用力振荡后加入少量四氯化碳,振荡,静置,上层接近无色,溶液分层且下层为紫红色,说明溴将碘离子氧化生成碘单质,离子方程式为Br2+2I-=2 Br-+I2,
①中氧化剂是Cl2、氧化产物是Br2,②中氧化剂是Cl2、氧化产物的I2,③中氧化剂是Br2、氧化产物是I2,
所以氧化性强弱顺序是Cl2>Br2>I2,元素的非金属性越强,其单质的氧化性越强,所以非金属性强弱顺序是Cl>Br>I,
故答案为:
| 实验操作 | 实验现象 | 离子方程式 | 单质氧化性 |
| 无色,橙红色 | 2Br-+Cl2=2 Cl-+Br2 | Cl2>Br2 | |
| 无色,紫色 | 2I-+Cl2=2 Cl-+I2 | Cl2>I2 | |
| 无色,紫色 | 2I-+Br2=2 Br-+I2 | Br2>I2 |
点评 本题以卤素单质之间的置换反应为载体考查同一主族元素性质递变规律,明确非金属性强弱与其单质氧化性强弱关系是解本题关键,易错点是化学用语正确运用,题目难度不大.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
16.核能是人类最具希望的未来能源,安全、合理地开发利用核能日益受到人们的关注.${\;}_{92}^{235}$U是核反应堆的重要原料,下列说法中正确的是( )
| A. | ${\;}_{92}^{235}$U的中子数为235 | |
| B. | ${\;}_{92}^{235}$U和${\;}_{92}^{238}$U是两种核素,它们互称为同素异形体 | |
| C. | 核反应属于化学变化 | |
| D. | 合理利用核能符合“低碳经济”要求 |
17.下列电离方程式的书写错误的是( )
| A. | NaHCO3═Na++H++CO32- | B. | NaHSO4═Na++H++SO42- | ||
| C. | MgCl2═Mg2++2Cl- | D. | Ca(OH)2═Ca2++2OH- |
14.已知某离子的结构示意图为 ,x-y<10,该粒子为( )
,x-y<10,该粒子为( )
 ,x-y<10,该粒子为( )
,x-y<10,该粒子为( )| A. | 阴离子 | B. | 原子 | C. | 阳离子 | D. | 原子 |
1.氢氧燃料电池已用于航天飞机,以30%KOH溶液为电解质溶液.电极反应如下:2H2+4OH--4e-=4H2O,O2+2H2O+4e-=4OH-.据此作出判断,下列说法中不正确的是( )
| A. | O2在正极发生还原反应 | B. | 供电时的总反应为2H2+O2═2H2O | ||
| C. | 燃料电池的能量转化率可达100% | D. | 氢氧燃料电池属于环境友好电池 |
18.实验室制备气体时,可根据反应物的状态、反应条件和生成气体的性质来选择气体的发生装置.
(1)实验室用氯酸钾和二氧化锰制氧气时,可选用的发生装置是A(写编号);
(2)实验室用食盐固体和浓硫酸制氯化氢气体时,可选用的发生装置是C(写编号),写出微热时的反应方程式NaCl+H2SO4 $\frac{\underline{\;微热\;}}{\;}$NaHSO4+HCl↑;
(3)高锰酸钾和二氧化锰都是强氧化剂,均可将浓盐酸氧化为氯气.
(a) 用浓盐酸和高锰酸钾制氯气的反应方程式如下:
2KMnO4+16HCl→2KCl+2MnCl2+5Cl2↑+8H2O
①用“单线桥”在上述方程式上标出电子转移的方向和数目.
②反应中Cl元素被氧化,KMnO4是氧化剂.当有1mol电子转移时,可生成气体11.2升(标准状态下).
(b) 用浓盐酸和二氧化锰制氯气的实验装置如图所示:
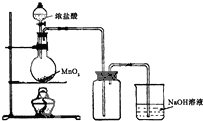
①写出圆底烧瓶中发生反应的化学方程式_MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
②实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是NaOH,有关的化学方程式Cl2+2NaOH=NaCl+NaClO+H2O.
| 编号 | A | B | C |
发 生 装 置 | 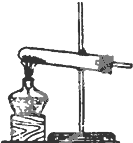 |  | 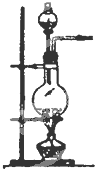 |
(2)实验室用食盐固体和浓硫酸制氯化氢气体时,可选用的发生装置是C(写编号),写出微热时的反应方程式NaCl+H2SO4 $\frac{\underline{\;微热\;}}{\;}$NaHSO4+HCl↑;
(3)高锰酸钾和二氧化锰都是强氧化剂,均可将浓盐酸氧化为氯气.
(a) 用浓盐酸和高锰酸钾制氯气的反应方程式如下:
2KMnO4+16HCl→2KCl+2MnCl2+5Cl2↑+8H2O
①用“单线桥”在上述方程式上标出电子转移的方向和数目.
②反应中Cl元素被氧化,KMnO4是氧化剂.当有1mol电子转移时,可生成气体11.2升(标准状态下).
(b) 用浓盐酸和二氧化锰制氯气的实验装置如图所示:

①写出圆底烧瓶中发生反应的化学方程式_MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
②实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是NaOH,有关的化学方程式Cl2+2NaOH=NaCl+NaClO+H2O.
15.下列说法中,正确的是( )
| A. | 电解质与非电解质本质区别是在水溶液或熔化状态下能否电离 | |
| B. | 纯碱、烧碱均属于碱 | |
| C. | 电离时能产生H+的化合物,一定是酸 | |
| D. | 非金属氧化物一定是酸性氧化物 |

 .(2分)
.(2分)