题目内容
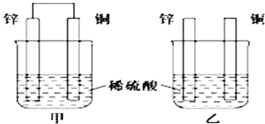
16. 有一Na2SO3固体因部分被氧化而变质.为测定样品纯度,甲、乙两位同学分别设计了如下实验方案:
有一Na2SO3固体因部分被氧化而变质.为测定样品纯度,甲、乙两位同学分别设计了如下实验方案:【甲同学】称取m g样品溶于水,加入过量的BaCl2溶液.过滤,向沉淀中加入过量盐酸,再过滤,将残留固体洗涤后进行烘干,冷却后称得质量为m1 g.
(1)BaCl2溶液必须过量的原因是使硫酸根离子能充分沉淀.在滤液中滴加碳酸钠溶液,若没有白色沉淀生成,则证明BaCl2溶液不足,还需继续在滤液中加入BaCl2溶液后进行过滤.
(2)洗涤残留固体的方法是在过滤器中加入蒸馏水,至浸没固体,使其自然流下,重复2-3次;在洗出液中滴加硝酸银溶液,可以判断残留固体是否洗涤干净.
(3)判断残留固体质量m1 g能够作为实验测定值代入计算式,推算样品纯度,必须补充的实验操作是重复烘干、冷却、称量,所得质量与m1的差值小于0.001g.
【乙同学】称取m g样品溶于水,配成溶液,用滴定管取V mL于锥形瓶中,用浓度为c mol/L的标准酸性高锰酸钾溶液滴定至终点.反应关系为:SO32-+MnO4-¾→SO42-+Mn2+ (未配平)
(4)配制样品溶液时,不一定需要的实验仪器是c(选填答案编号).
a.容量瓶 b.玻璃棒 c.滴定管 d.烧杯
(5)滴定终点的判断依据是滴入最后一滴酸性高锰酸钾溶液,溶液由无色变为紫色,且半分钟不褪色.
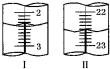
(6)上述滴定中,滴定管在注入酸性高锰酸钾溶液之前,先用蒸馏水洗净,再用标准高锰酸钾溶液润洗2-3次.滴定管液面变化如图所示,从图Ⅰ图Ⅱ显示消耗的高锰酸钾溶液体积为20.20mL.
分析 (1)实验中加入过量的BaCl2溶液,目的是使硫酸根离子能充分沉淀,在滤液中滴加碳酸钠溶液,若没有白色沉淀生成,则证明BaCl2溶液不足;
(2)过滤洗涤得到的硫酸钡沉淀,洗涤固体的方法同过滤,在过滤器中加入蒸馏水,至没过固体,然后过滤,洗涤干净的方法是依据沉淀表面可能附着有的氯化钡,设计实验检验氯离子的存在情况;
(3)必须确保生成的硫酸钡沉淀完全烘干,即所得质量与m1的差值小于0.001g;
(4)配制一定物质的量浓度的溶液时,要用到容量瓶、玻璃棒、烧杯,而不用滴定管,据此答题;
(5)用高锰酸钾溶液滴定亚硫钠溶液时,在滴定终点,溶液的颜色不褪色;
(6)根据滴定管的使用方法可知,滴定管在装溶液前必须用待装液润洗,根据滴定管构造及图示滴定管中液面读出消耗的高锰酸钾溶液体积.
解答 解:(1)实验中加入过量的BaCl2溶液,目的是使硫酸根离子能充分沉淀,在滤液中滴加碳酸钠溶液,若没有白色沉淀生成,则证明BaCl2溶液不足,
故答案为:使硫酸根离子能充分沉淀;碳酸钠;
(2)过过滤洗涤得到的硫酸钡沉淀,洗涤固体的方法同过滤,在过滤器中加入蒸馏水,至浸没固体,使其自然流下,重复2-3次,洗涤干净的方法是依据沉淀表面可能附着有的氯化钡,操作方法为:在最后洗涤过滤出的滤液中滴加硝酸银溶液,无沉淀生成,表明沉淀已洗净,
故答案为:在过滤器中加入蒸馏水,至浸没固体,使其自然流下,重复2-3次;硝酸银;
(3)判断残留固体质量m1g能够作为实验测定值代入计算式,推算样品纯度,必须重复烘干、冷却、称量,烘干后称量的质量与m1的差值小于0.001g,
故答案为:重复烘干、冷却、称量,所得质量与m1的差值小于0.001g;
(4)根据配制一定物质的量浓度的溶液过程中,需要使用的仪器有:一定容积的容量瓶、搅拌和引流时用到玻璃棒,溶解固体需要在烧杯中进行,定容时需要使用胶头滴管,所以需要的仪器有:a.容量瓶、b.玻璃棒、d.烧杯、e.胶头滴管,一般不需要的为c.滴定管,
故答案为:c;
(5)用高锰酸钾溶液滴定亚硫钠溶液时,当滴入最后一滴酸性高锰酸钾溶液,溶液由无色变为紫色,且半分钟不褪色,则说明已经达到滴定终点,
故答案为:滴入最后一滴酸性高锰酸钾溶液,溶液由无色变为紫色,且半分钟不褪色;
(6)根据滴定管的使用方法可知,滴定管在注入酸性高锰酸钾溶液之前,先用蒸馏水洗净,再用标准高锰酸钾溶液润洗2-3次,滴定管的每个小刻度为0.10mL,根据图2所示,图I显示初读数为2.40mL,图II所示的末读数为22.60mL,滴定总共消耗的高锰酸钾溶液的体积为:(22.60-2.40)mL=20.20mL,
故答案为:标准高锰酸钾溶液润洗2-3次;20.20mL.
点评 本题考查了性质实验方案的设计,题目难度中等,涉及中和滴定、配制一定物质的量浓度的溶液方法、化学实验装置判断等知识,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验能力,熟练掌握化学实验基本操作方法为解答关键

| A. | C5H12 | B. | C4H10 | C. | C3H8 | D. | C2H6 |
| A. | 同种元素的原子均具有相同的质子数和中子数 | |
| B. | 不同元素的原子构成的分子只含有极性键 | |
| C. | 第三周期非金属元素气态氢化物的稳定性越强,对应元素的最高价含氧酸的酸性越强 | |
| D. | 第ⅠA族和第ⅦA族元素从上到下随原子序数递增,单质的沸点均逐渐升高 |
①苯不能使酸性高锰酸钾溶液褪色;
②苯环中6个碳碳键键长完全相同;
③苯能在一定条件下与H2加成生环已烷;
④经实验测得邻二甲苯仅有一种结构;
⑤苯在FeCl3存在的条件下同液溴可发生取代反应,但不因化学变化而使溴水褪色;
⑥苯分子约lH-核磁共振谱图中只有一个峰值.
| A. | ②③④⑤ | B. | ①③④⑤⑥ | C. | ①②④⑤ | D. | ①②③④ |
| A. | O2在正极发生还原反应 | B. | 供电时的总反应为2H2+O2═2H2O | ||
| C. | 燃料电池的能量转化率可达100% | D. | 氢氧燃料电池属于环境友好电池 |
| A. | 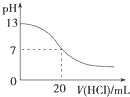 图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. |  图中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 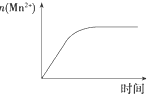 图表示10 mL 0.01 mol•L-1 KMnO4酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 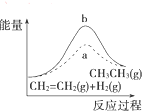 图中a、b曲线分别表示反应CH2═CH2(g)+H2(g)-→CH3CH3(g)△H<0使用和未使用催 化剂时,反应过程中的能量变化 |
| A. | 提出原子学说 | B. | 提出分子学说 | ||
| C. | 发现元素周期律 | D. | 发现能量守恒定律 |