题目内容
13.反应2A(g)+3B(g)=2C(g)+D(g)在四种不同情况下的反应速率如下,其中反应速率v最大的是( )| A. | v(A)=0.75mol/(L•s) | B. | v(B)=0.6mol/(L•s) | C. | v(C)=1.0mol/(L•s) | D. | v(D)=0.8mol/(L•s) |
分析 比较四种不同情况下反应速率的快慢,利用速率之比等于其化学计量数之比计算同一物质表示的速率进行比较.
解答 解:v(A):v(B):v(C):v(D)=2:3:2:1,转化为用A的浓度变化来表示的反应速率为:
A.v(A)=0.75 mol•L-1•s-1;
B.v(B)=0.6mol•L-1•s-1,则v(A)=$\frac{2}{3}$v(B)=0.40 mol•L-1•s-1;
C.v(C)=1.0 mol•L-1•s-1,则v(A)=v(C)=1.0 mol•L-1•s-1;
D.v(D)=0.8 mol•L-1•s-1,则v(A)=2v(D)=1.6 mol•L-1•min-1,
故反应进行的快慢顺序为D>C>A>B,
故选D.
点评 本题考查化学反应速率快慢比较,为高频考点,把握速率与其化学计量数比值大小比较或转化为同一物质表示的速率比较为解答的关键,也可利用比值法比较,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
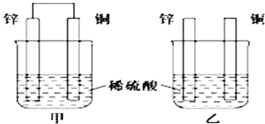
3.下列关于铝及其化合物的说法中不正确的是( )
| A. | 铝既可以用于食品包装,也可以用于建筑材料 | |
| B. | 氧化铝既可以用来冶炼铝,也可用作耐火材料 | |
| C. | 氢氧化铝既可以用于治疗胃酸过多,也可用来制备一些铝盐 | |
| D. | 明矾既能用来净水,也可用作消毒剂 |
1.氢氧燃料电池已用于航天飞机,以30%KOH溶液为电解质溶液.电极反应如下:2H2+4OH--4e-=4H2O,O2+2H2O+4e-=4OH-.据此作出判断,下列说法中不正确的是( )
| A. | O2在正极发生还原反应 | B. | 供电时的总反应为2H2+O2═2H2O | ||
| C. | 燃料电池的能量转化率可达100% | D. | 氢氧燃料电池属于环境友好电池 |
18.实验室制备气体时,可根据反应物的状态、反应条件和生成气体的性质来选择气体的发生装置.
(1)实验室用氯酸钾和二氧化锰制氧气时,可选用的发生装置是A(写编号);
(2)实验室用食盐固体和浓硫酸制氯化氢气体时,可选用的发生装置是C(写编号),写出微热时的反应方程式NaCl+H2SO4 $\frac{\underline{\;微热\;}}{\;}$NaHSO4+HCl↑;
(3)高锰酸钾和二氧化锰都是强氧化剂,均可将浓盐酸氧化为氯气.
(a) 用浓盐酸和高锰酸钾制氯气的反应方程式如下:
2KMnO4+16HCl→2KCl+2MnCl2+5Cl2↑+8H2O
①用“单线桥”在上述方程式上标出电子转移的方向和数目.
②反应中Cl元素被氧化,KMnO4是氧化剂.当有1mol电子转移时,可生成气体11.2升(标准状态下).
(b) 用浓盐酸和二氧化锰制氯气的实验装置如图所示:
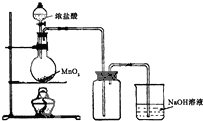
①写出圆底烧瓶中发生反应的化学方程式_MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
②实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是NaOH,有关的化学方程式Cl2+2NaOH=NaCl+NaClO+H2O.
| 编号 | A | B | C |
发 生 装 置 | 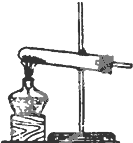 |  | 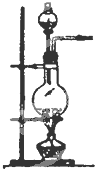 |
(2)实验室用食盐固体和浓硫酸制氯化氢气体时,可选用的发生装置是C(写编号),写出微热时的反应方程式NaCl+H2SO4 $\frac{\underline{\;微热\;}}{\;}$NaHSO4+HCl↑;
(3)高锰酸钾和二氧化锰都是强氧化剂,均可将浓盐酸氧化为氯气.
(a) 用浓盐酸和高锰酸钾制氯气的反应方程式如下:
2KMnO4+16HCl→2KCl+2MnCl2+5Cl2↑+8H2O
①用“单线桥”在上述方程式上标出电子转移的方向和数目.
②反应中Cl元素被氧化,KMnO4是氧化剂.当有1mol电子转移时,可生成气体11.2升(标准状态下).
(b) 用浓盐酸和二氧化锰制氯气的实验装置如图所示:

①写出圆底烧瓶中发生反应的化学方程式_MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
②实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是NaOH,有关的化学方程式Cl2+2NaOH=NaCl+NaClO+H2O.
5.下列各表述与示意图一致的是( )
| A. | 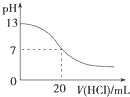 图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. |  图中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 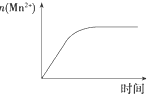 图表示10 mL 0.01 mol•L-1 KMnO4酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 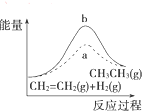 图中a、b曲线分别表示反应CH2═CH2(g)+H2(g)-→CH3CH3(g)△H<0使用和未使用催 化剂时,反应过程中的能量变化 |
2.若NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 16g氧气和臭氧的混合物中含有的氧原子数为NA | |
| B. | 标准状况下,22.4 L水中含有的氧原子数为NA | |
| C. | 0.5mol•L-1的AlCl3溶液中所含Al3+数目为0.5NA | |
| D. | 0.1 mol 氦气所含有的原子数为0.2NA |
3.在Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2的中,下列叙述正确的是( )
| A. | Fe3O4是还原剂 | B. | CO是氧化剂 | ||
| C. | 氧化剂得到6mol电子 | D. | 还原剂失去8mol电子 |