题目内容
一位同学在复习时遇到这样一道习题:某无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子.
(1)加入铝粉产生H2,说明铝具有 (填“氧化性”或“还原性”).
(2)该同学分析:若H+大量存在,则NO3-就不能大量存在.
设计实验证实如下:
①盐酸溶解Al2O3薄膜的离子方程式是 .
②根据现象ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
a.浅棕色气体是 .
b.实验1的目的是 .
c.实验1、2说明反应生成了NO,将生成NO的离子方程式补充完整:
Al+ NO3?+ ═ Al3++ NO↑+
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在.
重新设计实验证实如下:
为确认“刺激性气味”气体,进行如下实验:用湿润KI-淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝.
①刺激性气味的气体是 .
②产生该气体的离子方程式是 .
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是 .
(5)实验结果证实:NO3?在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物.习题中的无色溶液一定能大量存在的是Na+和OH-.
(1)加入铝粉产生H2,说明铝具有
(2)该同学分析:若H+大量存在,则NO3-就不能大量存在.
设计实验证实如下:
| 装 置 | 现 象 |
 |
ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,液面上方呈浅棕色 ⅲ.试管变热,溶液沸腾 |
②根据现象ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI-淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI-淀粉试纸检验浅棕色气体 | 试纸变蓝 |
b.实验1的目的是
c.实验1、2说明反应生成了NO,将生成NO的离子方程式补充完整:
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在.
重新设计实验证实如下:
| 装 置 | 现 象 |
 |
ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,有刺激性气味 |
①刺激性气味的气体是
②产生该气体的离子方程式是
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是
(5)实验结果证实:NO3?在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物.习题中的无色溶液一定能大量存在的是Na+和OH-.
考点:探究物质的组成或测量物质的含量,离子共存问题,铝的化学性质
专题:实验探究和数据处理题,离子反应专题,几种重要的金属及其化合物
分析:无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,因硝酸具有强氧化性,则无色溶液应为NaOH溶液,
(1)加入铝粉产生H2,Al失去电子,H得到电子;
(2)①盐酸与氧化铝反应生成氯化铝和水;
②液面上方呈浅棕色,一定不是氢气,为氮的氧化物,由将湿润KI-淀粉试纸置于空气中未变蓝,说明KI在空气中不能被氧化,而用湿润KI-淀粉试纸检验浅棕色气体试纸变蓝,则KI被氧化,即二氧化氮与水反应生成硝酸,再氧化碘离子生成碘单质;Al与H+、NO3-发生氧化还原反应生成硝酸铝、NO和水;
(3)用湿润KI-淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝,则气体为氨气,碱性条件下Al与NO3-发生氧化还原反应生成氨气;
(4)NaOH溶液中加入铝粉,结果只检验出有H2生成,即反应生成偏铝酸钠和氢气.
(1)加入铝粉产生H2,Al失去电子,H得到电子;
(2)①盐酸与氧化铝反应生成氯化铝和水;
②液面上方呈浅棕色,一定不是氢气,为氮的氧化物,由将湿润KI-淀粉试纸置于空气中未变蓝,说明KI在空气中不能被氧化,而用湿润KI-淀粉试纸检验浅棕色气体试纸变蓝,则KI被氧化,即二氧化氮与水反应生成硝酸,再氧化碘离子生成碘单质;Al与H+、NO3-发生氧化还原反应生成硝酸铝、NO和水;
(3)用湿润KI-淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝,则气体为氨气,碱性条件下Al与NO3-发生氧化还原反应生成氨气;
(4)NaOH溶液中加入铝粉,结果只检验出有H2生成,即反应生成偏铝酸钠和氢气.
解答:
解:无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,因硝酸具有强氧化性,则无色溶液应为NaOH溶液,
(1)加入铝粉产生H2,Al失去电子,H得到电子,则Al为还原剂,具有还原性,故答案为:还原性;
(2)①盐酸与氧化铝反应生成氯化铝和水,该离子反应为6H++Al2O3═2Al3++3H2O,故答案为:6H++Al2O3═2Al3++3H2O;
②液面上方呈浅棕色,一定不是氢气,为氮的氧化物,由将湿润KI-淀粉试纸置于空气中未变蓝,说明KI在空气中不能被氧化,而用湿润KI-淀粉试纸检验浅棕色气体试纸变蓝,则KI被氧化,即二氧化氮与水反应生成硝酸,再氧化碘离子生成碘单质,
a.由上述分析可知,浅棕色气体是NO2,故答案为:NO2;
b.实验1的目的是对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能,故答案为:对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能;
c.Al与H+、NO3-发生氧化还原反应生成硝酸铝、NO和水,离子反应为Al+NO3?+4H+═Al3++NO↑+2H2O,故答案为:1;1;4;H+;1;1;2;H2O;
(3)①用湿润KI-淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝,则气体为NH3,故答案为:NH3;
②由上述分析可知,碱性条件下Al与NO3-发生氧化还原反应生成氨气,离子反应为8Al+3NO3-+5OH-+2H2O═3NH3↑+8AlO2-,
故答案为:8Al+3NO3-+5OH-+2H2O═3NH3↑+8AlO2-;
(4)NaOH溶液中加入铝粉,结果只检验出有H2生成,即反应生成偏铝酸钠和氢气,反应为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(1)加入铝粉产生H2,Al失去电子,H得到电子,则Al为还原剂,具有还原性,故答案为:还原性;
(2)①盐酸与氧化铝反应生成氯化铝和水,该离子反应为6H++Al2O3═2Al3++3H2O,故答案为:6H++Al2O3═2Al3++3H2O;
②液面上方呈浅棕色,一定不是氢气,为氮的氧化物,由将湿润KI-淀粉试纸置于空气中未变蓝,说明KI在空气中不能被氧化,而用湿润KI-淀粉试纸检验浅棕色气体试纸变蓝,则KI被氧化,即二氧化氮与水反应生成硝酸,再氧化碘离子生成碘单质,
a.由上述分析可知,浅棕色气体是NO2,故答案为:NO2;
b.实验1的目的是对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能,故答案为:对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能;
c.Al与H+、NO3-发生氧化还原反应生成硝酸铝、NO和水,离子反应为Al+NO3?+4H+═Al3++NO↑+2H2O,故答案为:1;1;4;H+;1;1;2;H2O;
(3)①用湿润KI-淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝,则气体为NH3,故答案为:NH3;
②由上述分析可知,碱性条件下Al与NO3-发生氧化还原反应生成氨气,离子反应为8Al+3NO3-+5OH-+2H2O═3NH3↑+8AlO2-,
故答案为:8Al+3NO3-+5OH-+2H2O═3NH3↑+8AlO2-;
(4)NaOH溶液中加入铝粉,结果只检验出有H2生成,即反应生成偏铝酸钠和氢气,反应为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
点评:本题考查物质中的成分及性质,为高频考点,把握实验方案的设计及发生的氧化还原反应为解答的关键,注意设计思路与物质性质的关系,侧重实验学生分析能力、综合应用能力的考查,较好考查学生实验基本技能,题目难度中等.

练习册系列答案
相关题目
室温下,下列各组离子在指定溶液中能大量共存的是( )
| A、在pH=0的溶液中:Cl-、Na+、K+、C6H5-O-(C6H5一为苯基) |
| B、加入铝屑有氢气放出的溶液中:NH4+、K+、HCO3-、Br- |
| C、在H2SO3溶液中:HSO3-、K+、Cl-、Ba2+ |
| D、在葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+ |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、1mol?L-1 Na2CO3溶液中,含CO32-数目小于NA |
| B、标准状况下,11.2L O2和O3组成的混合气体含有原子数为NA |
| C、14 g聚乙烯与聚丙烯的混合物,含C-H键的数目为2NA |
| D、常温常压下,22.4L CO2与足量Na2O2反应转移电子数为NA |
化学与社会、生产、生活紧切相关.下列说法正确的是( )
| A、石英只能用于生产光导纤维 |
| B、从海水提取物质都必须通过化学反应才能实现 |
| C、为了增加食物的营养成分,可以大量使用食品添加剂 |
| D、淀粉、纤维素和脂肪在一定条件下都可以发生水解反应 |
下列叙述中,正确的是( )
| A、反应A2(g)+3B2(g)═2AB3(g)在一定温度下能自发进行,则该反应的△H<0 |
| B、将NH3 通入热的CuSO4 溶液中能使Cu2+还原成Cu |
| C、钙和镁的氯化物溶液蒸发结晶出来的固体都是水合物,经焙烧得相应无水盐 |
| D、用酸溶解金属铝时,溶解的速率与铝的纯度有关,纯度越高速率越大 |
下列反应的离子方程式正确的是( )
| A、过量氯气通入溴化亚铁溶液中:2Cl2+2Fe2++2Br-═4Cl-+2Fe3++Br2 |
B、向苯酚溶液中滴加Na2CO3溶液: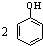 +CO32-→ +CO32-→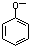 +CO2↑+H2O +CO2↑+H2O |
| C、足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- |
| D、用过量的冷氨水吸收SO2:SO2+2NH3?H2O═SO32-+2NH4++H2O |
 现有X、Y、Z、W、R五种元素,其中前四种为短周期主族元素.X原子的最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6;X、Z同主族,W与X、Y均不同周期,R2+的价电子排布式为3d5.
现有X、Y、Z、W、R五种元素,其中前四种为短周期主族元素.X原子的最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6;X、Z同主族,W与X、Y均不同周期,R2+的价电子排布式为3d5. A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:
A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表: 已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.
已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.