题目内容
室温下,下列各组离子在指定溶液中能大量共存的是( )
| A、在pH=0的溶液中:Cl-、Na+、K+、C6H5-O-(C6H5一为苯基) |
| B、加入铝屑有氢气放出的溶液中:NH4+、K+、HCO3-、Br- |
| C、在H2SO3溶液中:HSO3-、K+、Cl-、Ba2+ |
| D、在葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+ |
考点:离子共存问题
专题:离子反应专题
分析:A.pH=0的溶液呈酸性,弱酸的阴离子不能大量共存;
B.加入铝屑有氢气放出的溶液,可能为强碱性或非氧化性酸溶液;
C.与H2SO3反应的离子不能大量存在;
D.与葡萄糖反应的离子不能大量共存.
B.加入铝屑有氢气放出的溶液,可能为强碱性或非氧化性酸溶液;
C.与H2SO3反应的离子不能大量存在;
D.与葡萄糖反应的离子不能大量共存.
解答:
解:A.pH=0的溶液是酸溶液,C6H5O-与H+反应生成C6H5OH,故A错误;
B.加入铝屑有氢气放出的溶液中可以是酸溶液或碱溶液,HCO3-与两者均反应,NH4+与碱反应,故B错误;
C.离子指甲不发生任何反应,可大量共存,故C正确;
D.葡萄糖含醛基可被酸性高锰酸钾氧化,故D错误.
故选C.
B.加入铝屑有氢气放出的溶液中可以是酸溶液或碱溶液,HCO3-与两者均反应,NH4+与碱反应,故B错误;
C.离子指甲不发生任何反应,可大量共存,故C正确;
D.葡萄糖含醛基可被酸性高锰酸钾氧化,故D错误.
故选C.
点评:本题考查离子共存,为高频考点,把握习题中的信息及离子之间的反应为解答的关键,侧重氧化还原反应、复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
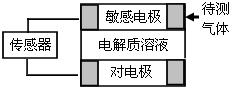 气体的自动化检测中常常应用原电池原理.如图为该电池工作的示意图:气体扩散进入敏感电极,发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.(对电极:即与敏感电极对应相反的电极)则下列说法中正确的是( )
气体的自动化检测中常常应用原电池原理.如图为该电池工作的示意图:气体扩散进入敏感电极,发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.(对电极:即与敏感电极对应相反的电极)则下列说法中正确的是( )| 待测气体 | 部分电极反应产物 |
| NO2 | NO |
| Cl2 | HCl |
| CO | CO2 |
| H2S | H2SO4 |
| A、检测Cl2时,电解质溶液中的阴离子向敏感电极移动 |
| B、上表气体检测时,敏感电极均作电池正极 |
| C、检测含相同物质的量的H2S和CO两份空气样本时,传感器上流过的电子物质的量之比为4:1 |
| D、检测H2S气体时,在对电极上充入空气,对电极上的电极反应式为:O2+2H2O+4e-═4OH- |
贝诺酯是解热镇痛抗炎药,其结构如图所示.下列有关说法正确的是( )
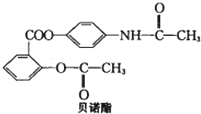

| A、分子式为C17H14O5N |
| B、在氢氧化钠水溶液中水解可以得到3种有机物钠盐 |
| C、1mol贝诺酯与H2发生加成反应最多消耗8mol H2 |
| D、贝诺酯既属于酯类又属于蛋白质类 |
下列对应化学反应的离子方程式正确的是( )
| A、氨水中通入过量SO2:SO2+NH3?H2O═NH4++HSO3- | ||||
| B、(CH3COO)2Ba溶液中加入稀硫酸:Ba2++SO42-═BaSO4↓ | ||||
C、用铜作电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| D、Al2(SO4)3溶液中加入足量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
下列事实、离子方程式及其对应关系均正确的是.( )
| A、向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H++4I-+O2═2I2+2H2O | ||||
| B、向K2Cr2O7溶液中滴加少量浓硫酸,溶液变为黄色:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+ | ||||
| C、0.01mol?L-1 NH4Al(SO4)2溶液与0.02mol?L-1 Ba(OH)2溶液等体积混合有白色沉淀生成:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | ||||
D、用铜电极电解饱和食盐水:2Cl-+2H2O
|
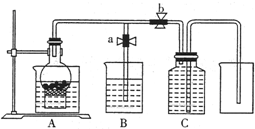 某同学设计如图所示装置来试验用粗铁粒与某浓度稀硝酸反应制取NO气体.
某同学设计如图所示装置来试验用粗铁粒与某浓度稀硝酸反应制取NO气体.
