题目内容
有①、②、③三瓶体积相等,浓度都是1mol/L的H2SO4溶液,将①加热蒸发至体积减小一半,在②中加入CH3COONa固体(加入后溶液仍呈酸性),③不作改变,然后以酚酞作指示剂,用NaOH溶液滴定上述三种溶液,消耗的NaOH溶液的体积是( )
| A、①=③>② |
| B、③>②>① |
| C、①=②=③ |
| D、①<②=③ |
考点:化学方程式的有关计算
专题:计算题
分析:①加热蒸发,硫酸不挥发,与③中硫酸的物质的量相等,②加入醋酸钠固体,混合酸提供氢离子总量与①、③的相等,据此判断.
解答:
解:①加热蒸发,硫酸不挥发,与③中硫酸的物质的量相等,②加入醋酸钠固体,虽然存在平衡,但混合酸提供氢离子总量与①、③的相等,用NaOH滴定,都发生H++OH-=H2O,故上述三种溶液,消耗的NaOH溶液的体积相等,故选C.
点评:本题考查滴定反应计算、弱电解质电离平衡等,难度不大,注意浓硫酸为高沸点酸,若为盐酸则不同,盐酸加热蒸发,HCl挥发.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
| A、t℃时,某溶液的pH=6,则该溶液一定为酸性 |
| B、常温下,pH=8的氨水稀释后,溶液中所有离子的浓度均降低 |
| C、常温下,将pH=11的NaOH溶液和pH=3的CH3COOH溶液等体积混合后,溶液的pH<7 |
| D、常温下,物质的量浓度和体积相同的K2CO3、K2SO4、HCl溶液混合后,溶液的pH<7 |
下列物质在水中的电离方程式中正确的是( )
A、NaHSO4═Na++HSO
| ||
| B、AlCl3═Al+3+3Cl- | ||
| C、KClO3═K++Cl-+3O2- | ||
D、Al2(SO4)3═2Al3++3SO
|
下列叙述或表示正确的是( )
| A、常温下pH均为3的醋酸和硫酸的水溶液,分别加水稀释100倍后,两种溶液的pH仍相同 |
| B、氢氧化钙溶液中加入过量的碳酸氢钙溶液的离子方程式:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| C、Ksp反映了难熔电解质在水中的溶解能力,它的大小与浓度无关,与温度无关 |
| D、c(H+)=1×10-2 mol?L的溶液:Fe2+、Ba2+、N03-、Cl-能大量共存 |
一定质量的Fe2O3、ZnO、CuO的固体混合粉末,在加热条件下用足量CO还原,得到金属混合物4.82g,将生成的CO2气体用足量的澄清石灰水吸收后,产生l0g白色沉淀.若用2mol?L-1的盐酸溶解该混合物,至少需要盐酸的体积为( )
| A、50 mL |
| B、100 mL |
| C、200 mL |
| D、缺少数据,无法计算 |
用H2还原xgCuO,当大部分固体变红时停止加热,冷却后得残留固体yg,共用掉z g H2,此时生成水的质量为( )
A、
| ||
B、
| ||
| C、9 z g | ||
D、
|
下列说法正确的是( )
| A、CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 |
| B、需要加热方能发生一定是吸热反应 |
| C、若反应X+Y═M是放热反应,该反应一定不用加热 |
D、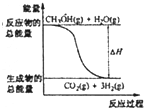 CH3OH(g)+H2O(g)═CO2(g)+3H2(g)反应能量变化如图所示,CH3OH转变H2的过程要吸收能量 |
 如图A为单质,B为一种具有还原性的二元含氧酸,C为溶液,且溶液中仅有一种溶质,D为气体,E、F为白色沉淀.物质间转化过程中需要加入的试剂未完全写出.回答下列问题:
如图A为单质,B为一种具有还原性的二元含氧酸,C为溶液,且溶液中仅有一种溶质,D为气体,E、F为白色沉淀.物质间转化过程中需要加入的试剂未完全写出.回答下列问题: