题目内容
20.将0.4mol/L丙酸(HPr)溶液125mL加水稀释至400mL;求稀释后溶液的pH(HPr的Ka=1.3×10-5)分析 设将0.4mol/L丙酸(HPr)溶液125mL加水稀释至400mL时,物质的量浓度变为xmol/L,根据稀释前后溶质的物质的量不变可有:0.4mol/L×0.125L=xmol/L×0.4L,可得知稀释后的浓度x;然后根据在丙酸溶液中存在电离平衡:HPr?H++Pr-,而由于丙酸对水的电离有抑制作用,故水电离出的氢离子浓度可以忽略不计,则溶液中有:c(H+)≈c(Pr-),根据HPr的Ka=1.3×10-5来计算.
解答 解:设将0.4mol/L丙酸(HPr)溶液125mL加水稀释至400mL时,物质的量浓度变为xmol/L,根据稀释前后溶质的物质的量不变可有:0.4mol/L×0.125L=xmol/L×0.4L,可得知稀释后的浓度x=0.125mol/L.
在丙酸溶液中存在电离平衡:HPr?H++Pr-,而由于丙酸对水的电离有抑制作用,故水电离出的氢离子浓度可以忽略不计,则溶液中有:c(H+)≈c(Pr-),根据HPr的Ka=1.3×10-5可知:Ka=1.3×10-5=$\frac{c({H}^{+})•c(P{r}^{-})}{c(HPr)}$=$\frac{c({H}^{+})^{2}}{c(HPr)}$=$\frac{c({H}^{+})^{2}}{0.125mol/L}$,解得c(H+)=1.3×10-3mol/L,则pH=3-lg1.3≈2.8,.
答:稀释后溶液的pH约为2.8.
点评 本题考查了借助电离平衡常数进行弱酸溶液中的pH的有关计算,难度不大,注意解题方法的掌握.

练习册系列答案
相关题目
7.若NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,1.56g Na2O2含有的阴离子数为0.02NA | |
| B. | 过氧化钠与二氧化碳反应产生氧气0.2mol,则转移0.8NA电子 | |
| C. | 0.1mol铁与高温水蒸汽反应,转移0.3NA电子 | |
| D. | 标准状况下,22.4L CCl4含有的分子数为NA |
8.下列装置应用于实验室制NO并回收硝酸铜的实验,能达到实验目的是( )
| A. | 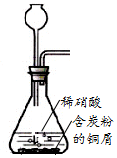 用装置制取NO | |
| B. |  用装置收集NO | |
| C. | 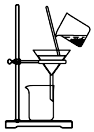 用装置分离炭粉和硝酸铜溶液 | |
| D. | 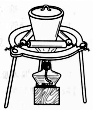 用装置蒸干硝酸铜溶液制Cu(NO3)2•3H2O |
8.下列说法正确的是( )
| A. | 水蒸气通过炽热的铁,生成Fe2O3和H2 | |
| B. | 用湿润的淀粉碘化钾试纸检验某气体,试纸变蓝,该气体一定是Cl2 | |
| C. | 除去NO中混有的少量NO2,可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO | |
| D. | 反应MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中,每析出12.8 g S共转移0.8mol |
5.在KCl、MgCl2、MgSO4形成的混合溶液中,c(K+)=0.1mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.2mol/L,则c(SO42-)为( )
| A. | 0.15mol/L | B. | 0.20mol/L | C. | 0.25mol/L | D. | 0.40mol/L |
9.将15.0gCu和Zn的混合物(内含少量不与硝酸反应的物质)与足量稀硝酸反应,假设还原产物只有NO气体,其体积在标准状况下为3.36L.将溶液稀释为500mL,测得溶液中c(H+)=0.2mol•L-1,此时溶液中NO3-的浓度为( )
| A. | 0.4mol•L-1 | B. | 0.6mol•L-1 | C. | 0.8mol•L-1 | D. | 1.1mol•L-1 |