题目内容
9.将15.0gCu和Zn的混合物(内含少量不与硝酸反应的物质)与足量稀硝酸反应,假设还原产物只有NO气体,其体积在标准状况下为3.36L.将溶液稀释为500mL,测得溶液中c(H+)=0.2mol•L-1,此时溶液中NO3-的浓度为( )| A. | 0.4mol•L-1 | B. | 0.6mol•L-1 | C. | 0.8mol•L-1 | D. | 1.1mol•L-1 |
分析 NO的物质的量为:n(NO)=$\frac{3.36L}{22.4L/mol}$=0.15mol,Cu、Zn与稀硝酸反应都生成+2价离子,据此可计算出铜离子、锌离子的总物质的量;反应后溶液中硝酸根离子存在于硝酸铜、硝酸锌和硝酸中,根据铜离子、锌离子的物质的量可计算出含有的硝酸根离子的物质的量,根据氢离子的物质的量可计算出硝酸中硝酸根离子的物质的量,从而可计算出反应后溶液中硝酸根离子总物质的量,最后根据c=$\frac{n}{V}$计算出稀释后溶液中硝酸根离子的浓度.
解答 解:标准状况下3.36LNO的物质的量为:n(NO)=$\frac{3.36L}{22.4L/mol}$=0.15mol,生成0.15molNO转移电子的物质的量为:0.15mol×(5-2)=0.45mol,
Cu、Zn与稀硝酸反应都生成+2价离子,则镁离子、铜离子离子离子的物质的量之和为:$\frac{0.45mol}{2}$=0.225mol,
0.225mol铜离子、锌离子结合NO3-的物质的量为:0.225mol×2=0.45mol,
反应后的溶液稀释为0.5L,c(H+)=0.2mol•L-1,则剩余硝酸的物质的量为:0.2mol•L-1×0.5L=0.1mol,
由N原子守恒可知,此时溶液中NO3-的物质的量为:0.45mol+0.1mol=0.55mol,
硝酸根离子的浓度为:$\frac{0.55mol}{0.5L}$=1.1mol/L,
故选D.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中电子守恒及质量守恒、原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
16.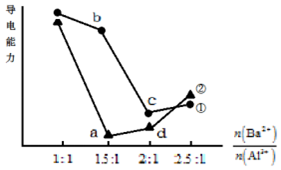 向两份20mL 0.1mol/L Ba(OH)2溶液中各加入一定量的KAl(SO4)2和Al2(SO4)3,溶液的导电性随$\frac{n(B{a}^{2+})}{n(A{l}^{3+})}$(混合前)的变化关系如右图所示.下列分析不正确的是( )
向两份20mL 0.1mol/L Ba(OH)2溶液中各加入一定量的KAl(SO4)2和Al2(SO4)3,溶液的导电性随$\frac{n(B{a}^{2+})}{n(A{l}^{3+})}$(混合前)的变化关系如右图所示.下列分析不正确的是( )
 向两份20mL 0.1mol/L Ba(OH)2溶液中各加入一定量的KAl(SO4)2和Al2(SO4)3,溶液的导电性随$\frac{n(B{a}^{2+})}{n(A{l}^{3+})}$(混合前)的变化关系如右图所示.下列分析不正确的是( )
向两份20mL 0.1mol/L Ba(OH)2溶液中各加入一定量的KAl(SO4)2和Al2(SO4)3,溶液的导电性随$\frac{n(B{a}^{2+})}{n(A{l}^{3+})}$(混合前)的变化关系如右图所示.下列分析不正确的是( )| A. | ①代表加入KAl(SO4)2的变化曲线 | |
| B. | a点溶液的pH值约为7 | |
| C. | b点溶液中大量存在的阳离子有Al3+和Ba2+ | |
| D. | c、d两点溶液中Ba(OH)2均已完全反应 |
17.化学与生活密切相关,下列叙述与盐类水解无关的是( )
| A. | 久置的Na2S溶液可闻到臭鸡蛋气昧 | |
| B. | 利用FeCl3溶液腐蚀铜电路板 | |
| C. | 用NaHCO3和Al2(SO4)3溶液可以制作泡沫灭火剂 | |
| D. | 向煮沸的蒸馏水中滴加饱和FeCl3溶液制取Fe(OH)3胶体 |
14.下列实验的原理用离子方程式表示正确的是( )
| A. | 向用NaHSO4溶液中滴加Ba(OH)2至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| B. | NaHSO4为离子化合物在熔融状态下能导电:NaHSO4=Na++H++SO42- | |
| C. | FeCl3腐蚀铜制印刷电路板:Fe3++Cu=Fe2++Cu2+ | |
| D. | NH4Cl溶液显酸性是因为NH4+发生水解:NH4++2H2O?NH3•H2O+H3O+ |
7.在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质.下列实验现象和结论一定正确的是( )
| A. | 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在 | |
| B. | 向氯水中滴加石蕊试液,溶液先变红后褪色,说明溶液中有盐酸和次氯酸 | |
| C. | 加入盐酸酸化,再加入硝酸银溶液产生白色沉淀,说明氯水中有Cl-存在 | |
| D. | 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在 |

 .
. .
.