题目内容
19.同温同压下,1体积X2气体与3体积Y2气体化合生成2体积气体化合物Z,则化合物Z的化学式可表示为( )| A. | XY3 | B. | XY | C. | X3Y | D. | X2Y3 |
分析 一定温度与压强下,气体的体积之比等于物质的量之比等于化学计量数之比,然后利用原子守恒定律来确定化学式.
解答 解:一定温度和压强下,1体积X2气体与3体积Y2气体化合生成2体积气体化合物,设该化合物为Z,
由气体的体积之比等于物质的量之比等于化学计量数之比,则反应表示为X2+3Y2═2Z,由原子守恒可知,Z的化学式为XY3,
故选A.
点评 本题考查阿伏伽德罗定律及其推论,明确一定温度与压强下气体体积与化学计量数的关系是解答本题的关键,题目难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
11.将0.2mol•L-1HCOOH溶液加水稀释,下列说法正确的是( )
| A. | 溶液中c(H+)和c(OH-)都减小 | B. | 溶液中c(H+)增大 | ||
| C. | 醋酸电离平衡向左移动 | D. | 溶液的pH增大 |
8.只用试管和胶头滴管而不用其它试剂无法区分的一组试剂是( )
| A. | KOH溶液和明矾的水溶液 | B. | Na2CO3溶液和HCl溶液 | ||
| C. | NaHCO3溶液和HCl溶液 | D. | 盐酸和NaAlO2溶液 |
9.甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,下列判断正确的是( )
| A. | 甲中由水电离出来的H+的物质的量浓度是乙$\frac{1}{10}$的倍 | |
| B. | 甲、乙两杯溶液物质的量浓度之间的关系为:c(甲)=10c(乙) | |
| C. | 中和含有等物质的量NaOH的溶液,需甲、乙两杯酸的体积(V)之间关系为:10V(甲)>V(乙) | |
| D. | 甲中的c(OH-)为乙中的c(OH-)的10倍 |

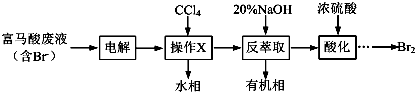

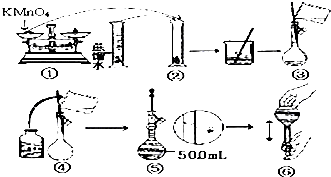 人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得一种弱酸草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得一种弱酸草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度: 在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g.试回答下列问题.
在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g.试回答下列问题.