题目内容
13.下列各组离子可能在指定溶液中大量共存的是( )①无色溶液中:Fe3+、Cl-、Na+、HCO3-、SO42-
②pH=11的溶液中:Na+,AlO2-、NO3-、S2-、SO32-
③加入Al能放出H2的溶液中:Na+、AlO2-、NO3-、S2-、SO32-
④使pH试纸呈红色的溶液中:Mg2+K+、Cl-,NH4+、SO42-
⑤酸性溶液中:Fe3+,MnO4-,Na+、SO32-.
| A. | ②④⑤ | B. | ①⑤ | C. | ②③④ | D. | ①②③ |
分析 ①Fe3+为黄色,且Fe3+、HCO3-相互促进水解;
②pH=11的溶液,显碱性;
③加入Al能放出H2的溶液,为非氧化性酸或强碱溶液;
④使pH试纸呈红色的溶液,显酸性;
⑤酸性溶液中离子之间发生氧化还原反应.
解答 解:①Fe3+为黄色,且Fe3+、HCO3-相互促进水解,不能共存,故错误;
②pH=11的溶液,显碱性,该组离子之间不反应,可大量共存,故正确;
③加入Al能放出H2的溶液,为非氧化性酸或强碱溶液,碱性溶液中该组离子之间不反应,可大量共存,故正确;
④使pH试纸呈红色的溶液,显酸性,该组离子之间不反应,可大量共存,故正确;
⑤酸性溶液中MnO4-、SO32-发生氧化还原反应,不能大量共存,故错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应、水解反应的离子共存考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
3.下列说法正确的是( )
| A. | SO2具有漂白性,能使品红溶液和酸性KMnO4溶液褪色且常作食品的漂白剂 | |
| B. | 活性炭、H2O2、O3等都有漂白性 | |
| C. | 干燥的氯气和氯水都有漂白性 | |
| D. | Na2O2也有漂白性,其漂白原理和SO2相似 |
1.如图,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在 F极附近显红色.则下列说法正确的是( )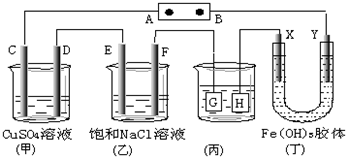

| A. | 若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则B极的电极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| C. | (丁)装置中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 | |
| D. | C、D、E、F电极均有单质生成,其物质的量比为1:1:2:2 |
18.下列说法正确的是( )
| A. | PH值均为12的氨水和氢氧化钠溶液各10 mL,分别加水稀释至100 mL,氨水溶液的PH值变化较大 | |
| B. | 将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 | |
| C. | FeI2的溶液中,缓慢通入少量氯气,再滴加少量CCl4,振荡,静置,下层液体为紫色 | |
| D. | 量筒、滴定管、容量瓶都可以用来量取液体,量筒、滴定管都有“0”刻度,量筒“0”刻度在下面,滴定管“0”刻度在上面,容量瓶有标线无其它刻度,滴定管和容量瓶使用前都需要检查是否漏水 |
5.下列说法正确的是( )
| A. | 用草酸钠标定高锰酸钾溶液的实验中,滴定终点的判断为:当滴入最后一滴高锰酸钾溶液时,溶液由无色变为浅紫色,且半分钟内不褪色 | |
| B. | 探究“影响硫代硫酸钠与稀硫酸反应速率的因素”的实验中,需要用到的计量仪器只需量筒、温度计 | |
| C. | 在溴富集过程中,可在分液漏斗中加入1mL溴水,再向其中加入3mL四氯化碳,振荡,静置、分液,得下层液体 | |
| D. | 在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
2.只用一种试剂可以区别NH4Cl、MgCl2、FeSO4、AlCl3、FeCl3五种溶液,这种试剂是( )
| A. | 稀硫酸 | B. | 氨水 | C. | AgNO3 溶液 | D. | NaOH溶液 |
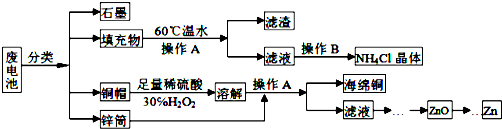
 (1)下列有关硅单质及其化合物的说法正确的是B.
(1)下列有关硅单质及其化合物的说法正确的是B.