题目内容
4.取一定量饱和FeCl3溶液,进行如下实验:(1)加入少量NaOH(s),FeCl3的水解程度增强(填“增强”“减弱”或“不变”).
(2)将溶液加热蒸干,并灼烧,最后得到的固体是Fe2O3(写化学式).
(3)FeCl3溶液中通入HCl(g),溶液的pH减小(填“增大”“减小”或“不变”),FeCl3的水解程度减弱(填“增强”“减弱”或“不变”).
(4)向FeCl3溶液中滴加石蕊试液,现象是溶液变红.
(5)向FeCl3溶液中加入过量的Mg片,现象是有气泡产生.
分析 饱和FeCl3溶液中,存在反应为FeCl3+3H2O?Fe(OH)3(胶体)+3HCl,
(1)加入少量NaOH(s),氢离子浓度减小,FeCl3的水解程度增强;
(2)根据三氯化铁在溶液中存在水解平衡,从平衡移动的角度分析并解答该题;
(3)FeCl3溶液中通入HCl(g),溶液的pH 减小,FeCl3的水解程度减弱;
(4)向FeCl3溶液中滴加石蕊试液,溶液呈酸,所以溶液变红;
(5)向FeCl3溶液中加入过量的Mg片,镁与氢离子反应生成氢气,由此分析解答.
解答 解:饱和FeCl3溶液中,存在反应为FeCl3+3H2O?Fe(OH)3(胶体)+3HCl,
(1)加入少量NaOH(s),氢离子浓度减小,水解平衡正向移动,所以FeCl3的水解程度增强,故答案为:增强;
(2)在FeCl3溶液中,Fe3+发生水解生成Fe(OH)3:FeCl3+3H2O?Fe(OH)3+3HCl,由于加热蒸发,使HCl挥发,破坏平衡,使平衡不断向右移动,结果生成Fe(OH)3,又由于灼热发生2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,使Fe(OH)3分解生成Fe2O3,故答案为:Fe2O3;
(3)FeCl3溶液中通入HCl(g),溶液的pH 减小,氢离子浓度增大,抑制FeCl3的水解,所以水解程度减弱,故答案为:减小;减弱;
(4)向FeCl3溶液中滴加石蕊试液,溶液呈酸,所以溶液变红,故答案为:溶液变红;
(5)向FeCl3溶液中加入过量的Mg片,镁与氢离子反应生成氢气,所以现象有气泡产生,故答案为:有气泡产生.
点评 本题考查盐类的水解,题目难度不大,注意水解平衡移动的影响因素.

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
15.下列表示物质结构的化学用语或模型正确的是( )
| A. | CO2分子比例模型: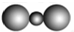 | B. | H2O2的电子式: | ||
| C. | 中子数为18的硫原子:${\;}_{16}^{34}$S | D. | 次氯酸的结构式:H-Cl-O |
16.下列说法正确的是( )
| A. | 因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性高锰酸钾溶液、石蕊试液褪色 | |
| B. | 能使品红溶液褪色的不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同 | |
| D. | SO2和Cl2等物质的量混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好 |

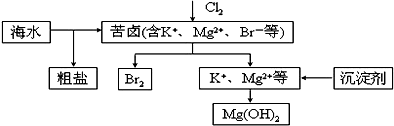 氯气在实验室和生产中都有重要的应用.
氯气在实验室和生产中都有重要的应用.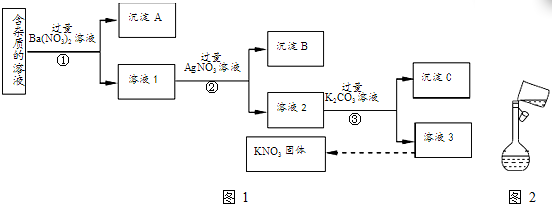
 ;
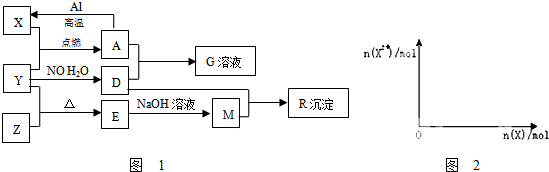
; A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(反应条件、有些反应物或产 物已略去):
A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(反应条件、有些反应物或产 物已略去):