题目内容
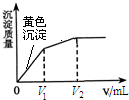 向10mL含等浓度的I-和Cl-的溶液中逐滴加入0.1mol?L-1的AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法不正确的是( )
向10mL含等浓度的I-和Cl-的溶液中逐滴加入0.1mol?L-1的AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法不正确的是( )| A、该实验可以证明AgI比AgCl更难溶 |
| B、加入V2 mL AgNO3溶液后,溶液中不含I- |
| C、V1=V2-V1 |
| D、向最终的沉淀中加入Na2S溶液,沉淀变成黑色 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:由图象可知,先生成碘化银沉淀后生成氯化银沉淀,根据发生反应:I-+Ag+=AgI↓、Cl-+Ag+=AgCl↓及溶液中I-和Cl-的物质的量判断消耗的硝酸银溶液的体积;氯化银、碘化银的溶解度小于硫化银,向硫化银中进入硫化钠,氯化银沉淀会转化成更难溶的硫化银沉淀,据此进行判断.
解答:
解:A、向10mL含等浓度的I-和Cl-的溶液中逐滴加入0.1mol?L-1的AgNO3溶液,先生成了黄色沉淀,说明碘化银比氯化银更难溶,故A正确;
B、难溶物在溶液中存在溶解平衡,加入V2 mLAgNO3溶液后,溶液中还含有I-,不过I-离子浓度很小,故B错误;
C、根据题中信息可知,碘离子和氯离子的物质的量相等,根据反应I-+Ag+=AgI↓、Cl-+Ag+=AgCl↓可知,二者消耗的硝酸银溶液的体积相等,即V1=V2-V1,故C正确;
D、由于Ag2S比AgCl、AgI更难溶,所以向最终的沉淀中加入Na2S溶液,AgCl、AgI沉淀会转化成黑色的Ag2S沉淀,故D正确;
故选B.
B、难溶物在溶液中存在溶解平衡,加入V2 mLAgNO3溶液后,溶液中还含有I-,不过I-离子浓度很小,故B错误;
C、根据题中信息可知,碘离子和氯离子的物质的量相等,根据反应I-+Ag+=AgI↓、Cl-+Ag+=AgCl↓可知,二者消耗的硝酸银溶液的体积相等,即V1=V2-V1,故C正确;
D、由于Ag2S比AgCl、AgI更难溶,所以向最终的沉淀中加入Na2S溶液,AgCl、AgI沉淀会转化成黑色的Ag2S沉淀,故D正确;
故选B.
点评:本题考查了难溶电解质的溶解平衡及沉淀转化本质,题目难度中等,注意掌握难溶电解质的转化本质及人机配合的应用方法,明确相同条件下,溶解度越小离子,优先生成沉淀.

练习册系列答案
相关题目
 将物质的量浓度相等的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液的pH随时间t变化的曲线如图所示,则下列说法中不正确的是( )
将物质的量浓度相等的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液的pH随时间t变化的曲线如图所示,则下列说法中不正确的是( )| A、A点pH小于7是因为Cu2+水解使溶液显酸性 |
| B、BC段阳极产物是Cl2 |
| C、整个过程中阳极先产生Cl2,后产生O2 |
| D、CD段电解的物质是水 |
下列离子方程式正确的是( )
| A、足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O→2HCO3- |
| B、FeSO4溶液在空气中变质:4Fe2++O2+2H2O→4Fe3++4OH- |
| C、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32- |
| D、碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+2Ca2++4OH-→2CaCO3↓+Mg(OH)2↓+2H2O |
人类的行为已经严重影响了生存环境,现在各种污染数不胜数.下列名词中与环境污染无关的是( )
①水华 ②赤朝 ③酸雨 ④光化学烟雾 ⑤臭氧空洞⑥潮汐 ⑦大脖子病 ⑧水体富营养化.
①水华 ②赤朝 ③酸雨 ④光化学烟雾 ⑤臭氧空洞⑥潮汐 ⑦大脖子病 ⑧水体富营养化.
| A、②⑥ | B、⑥⑦ |
| C、①③⑤ | D、④⑤⑧ |
室温下,对于0.10mol?L-1的氨水,下列判断正确的是( )
| A、其溶液的pH=13 |
| B、加入少量NaOH,溶液中c(NH4+)减小,Kw减小 |
| C、与AlCl3溶液反应的离子方程式为Al3++3OH-=Al(OH)3↓ |
| D、滴加0.10mol?L-1 HNO3溶液到pH=7,溶液中离子浓度关系为:c(NO3-)=c(NH4+)>c(H+)=c(OH-) |
 (1)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图装置模拟上述过程:
(1)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图装置模拟上述过程: 如图是用0.1000mol?mol-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
如图是用0.1000mol?mol-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答: