题目内容
室温下,对于0.10mol?L-1的氨水,下列判断正确的是( )
| A、其溶液的pH=13 |
| B、加入少量NaOH,溶液中c(NH4+)减小,Kw减小 |
| C、与AlCl3溶液反应的离子方程式为Al3++3OH-=Al(OH)3↓ |
| D、滴加0.10mol?L-1 HNO3溶液到pH=7,溶液中离子浓度关系为:c(NO3-)=c(NH4+)>c(H+)=c(OH-) |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.一水合氨是弱电解质,在水溶液里不完全电离;
B.水的离子积常数只与温度有关;
C.一水合氨是弱电解质,书写离子方程式时要写化学式;
D.溶液呈中性,则c(H+)=c(OH-),再结合电荷守恒判断.
B.水的离子积常数只与温度有关;
C.一水合氨是弱电解质,书写离子方程式时要写化学式;
D.溶液呈中性,则c(H+)=c(OH-),再结合电荷守恒判断.
解答:
解:A.一水合氨是弱电解质,在水溶液里不完全电离,所以0.10mol?L-1的氨水的pH小于13,故A错误;
B.水的离子积常数只与温度有关,温度不变,Kw不变,故B错误;
C.一水合氨是弱电解质,书写离子方程式时要写化学式,所以其离子方程式为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故C错误;
D.溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒,根据电荷守恒得c(NO3-)+c(OH-)=c(NH4+)+c(H+),所以得c(NO3-)=c(NH4+),水的电离较微弱,所以c(NH4+)>c(H+),故D正确;
故选D.
B.水的离子积常数只与温度有关,温度不变,Kw不变,故B错误;
C.一水合氨是弱电解质,书写离子方程式时要写化学式,所以其离子方程式为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故C错误;
D.溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒,根据电荷守恒得c(NO3-)+c(OH-)=c(NH4+)+c(H+),所以得c(NO3-)=c(NH4+),水的电离较微弱,所以c(NH4+)>c(H+),故D正确;
故选D.
点评:本题以弱电解质的电离为载体考查了离子方程式的书写、离子浓度大小的比较等知识点,根据弱电解质的电离特点结合电荷守恒来分析解答,难度不大.

练习册系列答案
相关题目
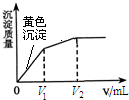 向10mL含等浓度的I-和Cl-的溶液中逐滴加入0.1mol?L-1的AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法不正确的是( )
向10mL含等浓度的I-和Cl-的溶液中逐滴加入0.1mol?L-1的AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法不正确的是( )| A、该实验可以证明AgI比AgCl更难溶 |
| B、加入V2 mL AgNO3溶液后,溶液中不含I- |
| C、V1=V2-V1 |
| D、向最终的沉淀中加入Na2S溶液,沉淀变成黑色 |
关于钠原子和钠离子,下列叙述的正确是( )
| A、它们的化学性质相似 |
| B、它们电子层数相同 |
| C、钠原子半径比钠离子半径小 |
| D、钠原子、钠离子均为同一元素 |
 将图所示实验装置的K闭合,下列判断正确的是( )
将图所示实验装置的K闭合,下列判断正确的是( )| A、Cu是正极 |
| B、电子沿 Zn→a→b→Cu 路径流动 |
| C、盐桥中Cl-移向CuSO4溶液 |
| D、片刻后可观察到滤纸a点变红色 |
若NA表示阿伏加德罗常数,下列说法正确的是( )
| A、在Na2O、Na2O2中,阳离子和阴离子个数比分别是2:1和1:1 |
| B、常温常压下,11.2L SO2气体中含有的分子数为0.5NA |
| C、一定条件下,密闭容器充入1mol N2和3mol H2充分反应,转移电子的数目为6NA |
| D、Na2CO3溶液中,若CO32-数目为NA,则Na+数目大于2NA |
原电池与电解池在生活和生产中有着广泛应用.下列有关判断中错误的是( )

| A、装置①研究的是电解CuCl2溶液,b电极上有红色固体析出 |
| B、装置②研究的是金属的吸氧腐蚀,Fe上的反应为Fe-2e-=Fe2+ |
| C、装置③研究的是电解饱和食盐水,B电极发生的反应:2Cl--2e-=Cl2↑ |
| D、三个装置中涉及的主要反应都是氧化还原反应 |
同分异构体指的是相同分子式不同分子结构的化合物,它描述的对象主体是化合物.同素异形体、同位素、同系物描述的对象主体依次为( )
| A、单质、原子、化合物 |
| B、元素、单质、化合物 |
| C、无机化合物、元素、有机化合物 |
| D、原子核、原子、分子 |
NA表示阿伏伽德罗常数.下列判断正确的是( )
| A、25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| B、分别为7.8g的Na2S和Na2O2中含有的阴离子数分别是0.1NA和0.2NA |
| C、常温常压下,22.4L CO2中含有的CO2分子数小于NA个 |
| D、1L 0.1mol/L的氨水含有0.1NA个NH3?H2O |