题目内容
 将物质的量浓度相等的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液的pH随时间t变化的曲线如图所示,则下列说法中不正确的是( )
将物质的量浓度相等的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液的pH随时间t变化的曲线如图所示,则下列说法中不正确的是( )| A、A点pH小于7是因为Cu2+水解使溶液显酸性 |
| B、BC段阳极产物是Cl2 |
| C、整个过程中阳极先产生Cl2,后产生O2 |
| D、CD段电解的物质是水 |
考点:电解原理
专题:电化学专题
分析:设CuSO4的和NaCl各nmol,电解分3个阶段:
AB段:阳极发生2Cl--2e-═Cl2↑,阴极发生Cu2++2e-═Cu,nmol氯离子失nmol电子,阴极:
nmol铜离子得nmol电子,由于铜离子水解使溶液酸性减弱,铜离子浓度逐渐减小,溶液pH值逐渐增大;
BC段:阳极发生4OH--4e-═2H2O+O2↑,阴极发生Cu2++2e-═Cu,nmol氢氧根离子失nmol电子(来源于水的电离),阴极:
n mol铜离子再得nmol电子,由于氢氧根离子消耗,溶液中氢离子浓度增大,溶液的pH值迅速减小;
CD段:阳极发生4OH--4e-═2H2O+O2↑,阴极发生2H++2e-═H2↑,氢氧根离子失去电子,阴极:氢离子得到电子,开始电解水,溶液中氢离子浓度逐渐增大,pH值减小,以此解答该题.
AB段:阳极发生2Cl--2e-═Cl2↑,阴极发生Cu2++2e-═Cu,nmol氯离子失nmol电子,阴极:
| 1 |
| 2 |
BC段:阳极发生4OH--4e-═2H2O+O2↑,阴极发生Cu2++2e-═Cu,nmol氢氧根离子失nmol电子(来源于水的电离),阴极:
| 1 |
| 2 |
CD段:阳极发生4OH--4e-═2H2O+O2↑,阴极发生2H++2e-═H2↑,氢氧根离子失去电子,阴极:氢离子得到电子,开始电解水,溶液中氢离子浓度逐渐增大,pH值减小,以此解答该题.
解答:
解:A.A点为硫酸铜溶液,为强酸弱碱盐,水解呈酸性,此时没有发生电解,故A正确;
B.AB段:阳极发生2Cl--2e-═Cl2↑,BC段:阳极发生4OH--4e-═2H2O+O2↑,故B错误;
C.由B分析可知,整个过程中阳极先产生Cl2,后产生O2,故C正确;
D.CD段发生2H++2e-═H2↑、4OH--4e-═2H2O+O2↑,即CD段电解的物质是水,故D正确.
故选B.
B.AB段:阳极发生2Cl--2e-═Cl2↑,BC段:阳极发生4OH--4e-═2H2O+O2↑,故B错误;
C.由B分析可知,整个过程中阳极先产生Cl2,后产生O2,故C正确;
D.CD段发生2H++2e-═H2↑、4OH--4e-═2H2O+O2↑,即CD段电解的物质是水,故D正确.
故选B.
点评:本题考查电解原理,明确电解过程中离子的移动及离子的放电顺序、发生的电极反应是解答本题的关键,并注意结合图象来分析解答,题目难度中等.

练习册系列答案
相关题目
某溶液既能溶解Al(OH)3又能溶解H2SiO3,在该溶液中可以大量共存的离子组是( )
| A、K+ Na+ HCO3- NO3- |
| B、Na+ SO42-Cl- ClO- |
| C、H+ Mg2+ SO42- NO3- |
| D、Ag+ K+ NO3- Na+ |
下列表示对应化学反应的离子方程式正确的是( )
| A、氯气溶于水:Cl2+H2O?H++Cl-+HClO |
| B、铝溶于氢氧化钠溶液:Al+2OH-+H2O=AlO2-+2H2↑ |
| C、少量的CO2通入氨水中:CO2+NH3?H2O=NH4++HCO3- |
| D、用醋酸溶液除去水垢:2H++CaCO3=Ca2++CO2↑+H2O |
用铂电极电解CuSO4和KNO3的混合溶液1L,经过一段时间后,两极均得到标准状况下22.4L的气体,则原混合溶液中CuSO4的物质的量浓度为( )
| A、1.0mol/L |
| B、0.8mol/L |
| C、1.5mol/L |
| D、0.5mol/L |
下列离子方程式书写正确的是( )
| A、氯化铁溶液腐蚀铜箔:Fe3++Cu=Fe2++Cu2+ | ||||
| B、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO2↑+H2O | ||||
C、电解饱和食盐水:2Cl-+2H2O
| ||||
| D、SO2通入足量的氨水中:SO2+NH3+H2O═NH4++HSO3- |
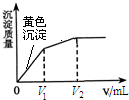 向10mL含等浓度的I-和Cl-的溶液中逐滴加入0.1mol?L-1的AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法不正确的是( )
向10mL含等浓度的I-和Cl-的溶液中逐滴加入0.1mol?L-1的AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法不正确的是( )| A、该实验可以证明AgI比AgCl更难溶 |
| B、加入V2 mL AgNO3溶液后,溶液中不含I- |
| C、V1=V2-V1 |
| D、向最终的沉淀中加入Na2S溶液,沉淀变成黑色 |