题目内容
Ⅰ.实验室配制1mol/L Na2CO3溶液250ml.
(1)需要固体Na2CO3 g;
(2)该溶液中的阳离子数目为 个;
(3)需要物质的量浓度为5mol/L 的Na2CO3溶液 ml;
(4)将该溶液与足量稀硫酸反应,产生的气体在标准状况下的体积为 L.
(5)配制该溶液的操作顺序是(用字母表示,不重复使用) .
A.称量 B.洗涤 C.定容 D.溶解 E.摇匀 F.转移
Ⅱ.现有四种可溶性盐,其阳离子分别是K+、Ba2+、Fe3+、Ag+中的某一种,阴离子分别是Cl-、SO42-、CO32-、NO3-中的某一种.小华同学说,不用做实验就可以确定这四种盐,那么他确定的四种盐的化学式分别为: .
(1)需要固体Na2CO3
(2)该溶液中的阳离子数目为
(3)需要物质的量浓度为5mol/L 的Na2CO3溶液
(4)将该溶液与足量稀硫酸反应,产生的气体在标准状况下的体积为
(5)配制该溶液的操作顺序是(用字母表示,不重复使用)
A.称量 B.洗涤 C.定容 D.溶解 E.摇匀 F.转移
Ⅱ.现有四种可溶性盐,其阳离子分别是K+、Ba2+、Fe3+、Ag+中的某一种,阴离子分别是Cl-、SO42-、CO32-、NO3-中的某一种.小华同学说,不用做实验就可以确定这四种盐,那么他确定的四种盐的化学式分别为:
考点:配制一定物质的量浓度的溶液,常见离子的检验方法
专题:实验题,物质检验鉴别题
分析:Ⅰ.(1)根据n=cV、m=nM计算出250mL 1mol/L Na2CO3溶液中溶质碳酸钠的质量;
(2)碳酸钠溶液中阳离子为钠离子,根据碳酸钠的物质的量计算出钠离子的物质的量及数目;
(3)根据溶液稀释过程中溶质的物质的量不变计算出需要5mol/L 的Na2CO3溶液的体积;
(4)根据生成二氧化碳的物质的量=碳酸钠的物质的量计算出二氧化碳的物质的量及标况下的体积;
(5)根据配制 一定物质的量浓度的溶液的操作方法进行排序;
Ⅱ.四种可溶性盐,根据离子共存判断离子之间可以形成的可溶性盐,如银离子只能结合硝酸根离子、则钡离子只能结合氯离子、铁离子只能结合硫酸根离子等,据此完成本题.
(2)碳酸钠溶液中阳离子为钠离子,根据碳酸钠的物质的量计算出钠离子的物质的量及数目;
(3)根据溶液稀释过程中溶质的物质的量不变计算出需要5mol/L 的Na2CO3溶液的体积;
(4)根据生成二氧化碳的物质的量=碳酸钠的物质的量计算出二氧化碳的物质的量及标况下的体积;
(5)根据配制 一定物质的量浓度的溶液的操作方法进行排序;
Ⅱ.四种可溶性盐,根据离子共存判断离子之间可以形成的可溶性盐,如银离子只能结合硝酸根离子、则钡离子只能结合氯离子、铁离子只能结合硫酸根离子等,据此完成本题.
解答:
解:Ⅰ.1mol/L Na2CO3溶液250mL,含有溶质的物质的量为:1mol/L×0.25L=0.25mol,
(1)配制1mol/L Na2CO3溶液250mL,需要碳酸钠的质量为:106g/mol×0.25mol=26.5g,故答案为:26.5g;
(2)0.25mol碳酸钠中含有0.5mol钠离子,该溶液中的阳离子数目为N(Naa+)=0.5NA,故答案为:0.5NA;
(3)需要物质的量浓度为5mol/L 的Na2CO3溶液体积为:
=0.05L=50mL,故答案为:50;
(4)0.25mol碳酸钠与足量盐酸反应,根据碳原子守恒,生成了0.25mol二氧化碳,标况下二氧化碳的体积:22.4L/mol×0.25mol=5.6L,故答案为:5.6L;
(5)配制一定物质的量浓度的溶液步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,所以正确顺序为ADFBCE,故答案为:ADFBCE;
Ⅱ.四种可溶性盐,其阳离子为:K+、Ba2+、Fe3+、Ag+,阴离子为:Cl-、SO42-、CO32-、NO3-,由离子共存可知:Ag+离子只能与NO3-离子结合形成AgNO3、则Ba2+只能与剩下的离子中Cl-结合生成BaCl2、Fe3+只能与SO42-、形成可溶性Fe2(SO4)3 ,最后剩下两种离子结合形成K2CO3,
所以以上离子之间形成的可溶性盐为:AgNO3 、K2CO3 、Fe2(SO4)3、BaCl2,
故答案为:AgNO3 、K2CO3 、Fe2(SO4)3、BaCl2.
(1)配制1mol/L Na2CO3溶液250mL,需要碳酸钠的质量为:106g/mol×0.25mol=26.5g,故答案为:26.5g;
(2)0.25mol碳酸钠中含有0.5mol钠离子,该溶液中的阳离子数目为N(Naa+)=0.5NA,故答案为:0.5NA;
(3)需要物质的量浓度为5mol/L 的Na2CO3溶液体积为:
| 0.25mol |
| 5mol/L |
(4)0.25mol碳酸钠与足量盐酸反应,根据碳原子守恒,生成了0.25mol二氧化碳,标况下二氧化碳的体积:22.4L/mol×0.25mol=5.6L,故答案为:5.6L;
(5)配制一定物质的量浓度的溶液步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,所以正确顺序为ADFBCE,故答案为:ADFBCE;
Ⅱ.四种可溶性盐,其阳离子为:K+、Ba2+、Fe3+、Ag+,阴离子为:Cl-、SO42-、CO32-、NO3-,由离子共存可知:Ag+离子只能与NO3-离子结合形成AgNO3、则Ba2+只能与剩下的离子中Cl-结合生成BaCl2、Fe3+只能与SO42-、形成可溶性Fe2(SO4)3 ,最后剩下两种离子结合形成K2CO3,
所以以上离子之间形成的可溶性盐为:AgNO3 、K2CO3 、Fe2(SO4)3、BaCl2,
故答案为:AgNO3 、K2CO3 、Fe2(SO4)3、BaCl2.
点评:本题考查了配制一定物质的量浓度的溶液方法、离子共存的判断,题目难度中等,注意掌握配制一定物质的量浓度的溶液的方法,明确常见离子之间的反应条件,能够根据离子共存判断哪些离子之间可以形成可溶性物质.

练习册系列答案
相关题目
下列表示对应化学反应的离子方程式正确的是( )
| A、氯气溶于水:Cl2+H2O?H++Cl-+HClO |
| B、铝溶于氢氧化钠溶液:Al+2OH-+H2O=AlO2-+2H2↑ |
| C、少量的CO2通入氨水中:CO2+NH3?H2O=NH4++HCO3- |
| D、用醋酸溶液除去水垢:2H++CaCO3=Ca2++CO2↑+H2O |
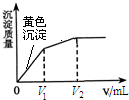 向10mL含等浓度的I-和Cl-的溶液中逐滴加入0.1mol?L-1的AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法不正确的是( )
向10mL含等浓度的I-和Cl-的溶液中逐滴加入0.1mol?L-1的AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法不正确的是( )| A、该实验可以证明AgI比AgCl更难溶 |
| B、加入V2 mL AgNO3溶液后,溶液中不含I- |
| C、V1=V2-V1 |
| D、向最终的沉淀中加入Na2S溶液,沉淀变成黑色 |
下列各组物质不属于同分异构体的是( )
| A、间二甲苯和乙苯 |
| B、2-甲基2,4-己二烯和3,4-二甲基-1-戊炔 |
| C、2,2,3-三甲基戊烷和3-乙基己烷 |
| D、2-甲基丙烯酸和甲酸正丙酯 |
 将图所示实验装置的K闭合,下列判断正确的是( )
将图所示实验装置的K闭合,下列判断正确的是( )| A、Cu是正极 |
| B、电子沿 Zn→a→b→Cu 路径流动 |
| C、盐桥中Cl-移向CuSO4溶液 |
| D、片刻后可观察到滤纸a点变红色 |
 【化学--选修2化学与技术】
【化学--选修2化学与技术】

 )上的加成反应,写出该反应产物的结构简式
)上的加成反应,写出该反应产物的结构简式