题目内容
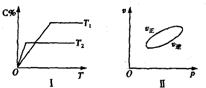 可逆反应aA(g)+bB(g)?cC(g)+dD(s)△H=QkJ/mol,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示.据图分析,以下说法正确的是( )
可逆反应aA(g)+bB(g)?cC(g)+dD(s)△H=QkJ/mol,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示.据图分析,以下说法正确的是( )| A、T1<T2,Q>0 |
| B、增大压强,物质B的转化率减小 |
| C、至反应达平衡时,混合气体的密度会变化 |
| D、a+b>c+d |
考点:化学平衡的影响因素
专题:化学反应中的能量变化
分析:可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短.由图象可知T2>T1,温度越高,平衡时C的百分含量(C%)越小,故此反应的正反应为放热反应;
当其他条件一定时,增大压强,正速率大于逆反应速率,说明平衡正移,所以正反应为气体物质的量减小的反应,即a+b<c.
A、由以上分析可知T2>T1,Q<0;
B、由以上分析可知,该反应为正反应为气体物质的量减小的反应根据压强对平衡的影响分析;
C、反应前后气体体积不变,气体质量减少,所以密度减小,混合气体的密度不再变化即是平衡状态;
D、由以上分析可知,正反应为气体物质的量减小的反应,即a+b<c.
当其他条件一定时,增大压强,正速率大于逆反应速率,说明平衡正移,所以正反应为气体物质的量减小的反应,即a+b<c.
A、由以上分析可知T2>T1,Q<0;
B、由以上分析可知,该反应为正反应为气体物质的量减小的反应根据压强对平衡的影响分析;
C、反应前后气体体积不变,气体质量减少,所以密度减小,混合气体的密度不再变化即是平衡状态;
D、由以上分析可知,正反应为气体物质的量减小的反应,即a+b<c.
解答:
解:可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短.由图象可知T2>T1,温度越高,平衡时C的百分含量(C%)越小,故此反应的正反应为放热反应;
当其他条件一定时,增大压强,正速率大于逆反应速率,说明平衡正移,所以正反应为气体物质的量减小的反应,即a+b<c.
A、由以上分析可知T2>T1,Q<0,故A错误;
B、由以上分析可知,该反应为正反应为气体物质的量减小的反应,增大压强,平衡正移,B的转化率增大,故B错误;
C、反应前后气体体积不变,气体质量减少,所以密度减小,混合气体的密度不再变化即是平衡状态,故C正确;
D、由以上分析可知,正反应为气体物质的量减小的反应,即a+b<c,所以a+b<c+d,故D错误;
故选C.
当其他条件一定时,增大压强,正速率大于逆反应速率,说明平衡正移,所以正反应为气体物质的量减小的反应,即a+b<c.
A、由以上分析可知T2>T1,Q<0,故A错误;
B、由以上分析可知,该反应为正反应为气体物质的量减小的反应,增大压强,平衡正移,B的转化率增大,故B错误;
C、反应前后气体体积不变,气体质量减少,所以密度减小,混合气体的密度不再变化即是平衡状态,故C正确;
D、由以上分析可知,正反应为气体物质的量减小的反应,即a+b<c,所以a+b<c+d,故D错误;
故选C.
点评:本题考查了体积分数随温度曲线及速率随压强变化曲线,难度不大,明确“先拐先平数值大”是解本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、通入足量CO2后的溶液中:Na+、SiO32-、C6H5O-、CH3COO- | ||
B、
| ||
| C、pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42- | ||
| D、c(ClO-)=1.0 mol?L-1的溶液:Na+、SO32-、S2-、SO42- |
下面均是正丁烷与氧气反应的热化学方程式(25℃,101kPa)由此判断,正丁烷的燃烧热是( )
①C4H10(g)+
O2(g)═4CO2(g)+5H2O(l)△H=-2878KJ/mol
②C4H10(g)+
O2(g)═4CO2(g)+5H2O(g)△H=-2658KJ/mol
③C4H10(g)+
O2(g)═4CO(g)+5H2O(l)△H=-1746KJ/mol
④C4H10(g)+
O2(g)═4CO(g)+5H2O(g)△H=-1526KJ/mol.
①C4H10(g)+
| 13 |
| 2 |
②C4H10(g)+
| 13 |
| 2 |
③C4H10(g)+
| 9 |
| 2 |
④C4H10(g)+
| 9 |
| 2 |
| A、2 878 kJ/mol |
| B、2 658 kJ/mol |
| C、1 746 kJ/mol |
| D、1 526 kJ/mol |
可逆反应A+3B?2C+2D,在4种不同情况下的反应速率分别为单位mol?Lˉ1?sˉ1:①VA=0.20;②VB=0.60;③VD=0.50;④VC=0.45;该反应速率最快的是( )
| A、② | B、③ | C、①和④ | D、②和③ |
FeCl3溶液、Fe(OH)3胶体共同具备的性质是( )
| A、都呈透明的红褐色 |
| B、都比较稳定,密封保存一段时间都不会产生沉淀 |
| C、分散质颗粒直径相同 |
| D、当有光线透过时,都能产生丁达尔效应 |
下列关于化学用语叙述正确的是( )
A、丙烷分子的球棍模型: |
B、甲醛的电子式: |
| C、乙醇的结构简式:C2H6O |
| D、乙烯的结构式:CH2=CH2 |
下列化学用语表述一定正确的是( )
A、甲醛的电子式: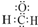 | ||||
B、用铜电极电解盐酸溶液:2H++2Cl
| ||||
C、溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-
| ||||
| D、澄清石灰水中加入过量的小苏打溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |